 Acides, bases
et pH - Titrage acide-base
Acides, bases
et pH - Titrage acide-base
Logiciels et bibliographie
Programme d'étude
Cours
Acides, bases et pH
- Les diverses théories
- Acides et bases conjugués
- La notion de pH
- Cas de l'eau
- Mesure du pH
- Acides et bases forts
- Acides et bases faibles
- Hydrolyse des sels
- Solutions tampons
- Titrage acide-base
- Constante de dissociation*
- pKa des solutés*
- Calcul du pH*
- pH des acides et bases faibles seuls*
- pH des ampholytes*
- pH des solutions tampons*
- Formules et table pKa*
- Exercices*
Les acides et les bases sont des substances antagonistes qui réagissent en solution, formant de l'eau et un sel au cours d'un phénomène appelé neutralisation.
Exemple : HCl + NaOH  H2O
+ NaCl
H2O
+ NaCl
Soit en détail : HCl + H2O  H3O+
+ Cl–
et
NaOH
H3O+
+ Cl–
et
NaOH  Na+
+ OH–
Na+
+ OH–
Na+ + OH–
+ H3O+ + Cl–  2 H2O + Na+ + Cl–
2 H2O + Na+ + Cl–
La neutralisation n'est donc rien d'autre que la réaction entre les ions H3O+ et OH– avec formation d'eau.
Une technique très utilisée en chimie est basée sur le principe de la neutralisation d’un acide par une base (ou inversement). Elle permet de doser un acide ou une base au cours de ce que l'on appelle un titrage acidimétrique.
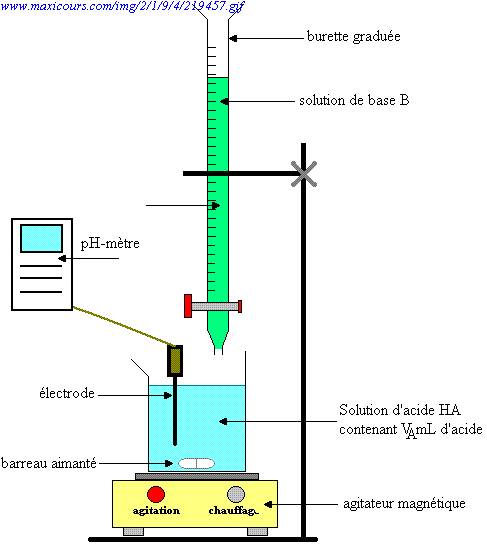 |
Le principe est simple, on ajoute progressivement une solution de concentration connue et de pH opposé à la solution dont on cherche à déterminer la concentration. On observe le changement de pH et on arrête l’adjonction quand la réaction est terminée. Attention, cela ne signifie pas toujours un pH neutre car le sel formé n'est pas forcément neutre! On appelle ce point le point d'équivalence. |
Titrage de HCl 0,1 M par NaOH 0,1 M
On prélève une quantité déterminée de HCl 0,1 M, par exemple 20 ml. Pour neutraliser complètement ces ions H3O+, il faut une quantité équivalente d’ions OH– soit par exemple 20 ml de NaOH 0,1 M.Ces 20 ml vont être ajoutés par petites quantités successives à l'aide d'une burette. On mesure le pH en fonction du volume de NaOH ajouté et on reporte les mesures sur un graphique et on obtient une courbe de titrage:
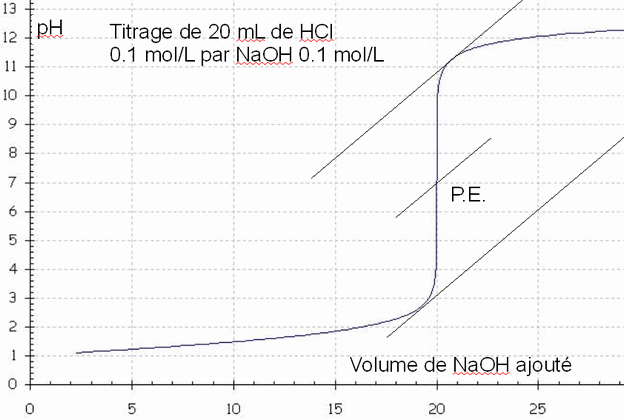
- Le pH de la solution initiale (HCl 0,1M) est de 1 et
au fur et à mesure que l'on ajoute NaOH la réaction de neutralisation
se produit:
HCl + NaOH H2O
+ NaCl
H2O
+ NaCl - Les ions H3O+ sont neutralisés peu à peu, leur concentration diminue, ce qui fait augmenter le pH. L’augmentation est d’abord lente puis rapide autour du point de neutralisation.
- Quand on a ajouté 20 ml de NaOH on a neutralisé tous les H3O+ de HCl, il n'y a plus que de l'eau et du NaCl. Le pH = 7 car [H3O+] = [OH–] proviennent de l'autoprotolyse de H2O. Ce point particulier s'appelle point d'équivalence P.E.
Application : Calculer la courbe de titrage précédente. Ceci en prenant un point tous les 5 ml jusqu'à 15 ml puis tous les 0.5 ml autour du P.E.
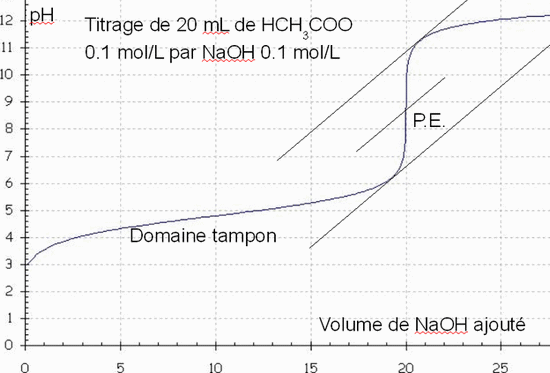
Titrage de CH3COOH 0,1 M par NaOH 0,1 M
CH3COOH
est un acide faible et la réaction est: CH3COOH
+
NaOH  CH3COONa
+ H2O
CH3COONa
+ H2O
Au début il n'y a qu'un acide faible, au fur et à mesure que l'on ajoute NaOH, il se forme CH3COO- (base conjuguée de CH3COOH) qui coexiste avec le CH3COOH non titré. On est en présence d’un mélange tampon, ce qui explique la variation lente du pH dans cette région (domaine tampon).
Au P.E. tous les H3O+ provenant de CH3COOH sont neutralisés, il ne reste que CH3COONa et H2O. Une légère hydrolyse se produit pourtant car CH3COO– est une base assez forte (l’acide conjugué est faible) donc le pH du P.E. est >7.
Question : quel indicateur coloré pourrait-on utiliser pour effectuer ce titrage ?
Exercice 1: On
ajoute 10 ml de NaOH 0.01
mol/L à 10 ml d'une solution HCl de pH =
3. Quel est le pH du
mélange ?

Exercice 2: On neutralise 20 ml d'une solution d'acide
sulfurique avec 15,1
ml d'hydroxyde de sodium 0,1 M. Poser l'équation du dosage et calculer
la
concentration de l'acide.

Exercice 3: On neutralise 10 ml de NaOH avec 11,4 ml de H3PO4
0,5 M. Calculer
la concentration de NaOH.

Exercice 4: On neutralise tous les ions
hydronium apportés par 25.0 ml d'une
solution d'acide phosphorique avec 38,1 ml d'hydroxyde de sodium 3.00
g/l.
a) Calculer la concentration de l'acide en g/l.
b)
Quelle est la valeur du pH de la solution obtenue après la
neutralisation complète?
