 Acides, bases
et pH - Acides et bases faibles
Acides, bases
et pH - Acides et bases faibles
Logiciels et bibliographie
Programme d'étude
Cours
Acides, bases et pH
- Les diverses théories
- Acides et bases conjugués
- La notion de pH
- Cas de l'eau
- Mesure du pH
- Acides et bases forts
- Acides et bases faibles
- Hydrolyse des sels
- Solutions tampons
- Titrage acide-base
- Constante de dissociation*
- pKa des solutés*
- Calcul du pH*
- pH des acides et bases faibles seuls*
- pH des ampholytes*
- pH des solutions tampons*
- Formules et table pKa*
- Exercices*
Les acides et bases faibles sont des substances que l'eau ne dissocie pas entièrement:
HCH3COO + H2O
 H3O+
+ CH3COO–
HCH3COO n'est pas
entièrement
dissocié
H3O+
+ CH3COO–
HCH3COO n'est pas
entièrement
dissocié
Cela signifie que la base conjuguée CH3COO– peut se lier avec H3O+ pour former HCH3COO (réaction inverse). Donc le ion CH3COO– est basique. Une telle solution n'est donc pas aussi acide à même concentration qu'un acide fort.
On peut faire le même raisonnement avec une base faible :
NH3
+ H2O  NH4+
+ OH –
NH4+
+ OH –
Cela signifie que l'acide
conjugué NH4+
peut se lier avec OH – pour
former NH3 (réaction inverse). Donc le
ion NH4+ est
acide. A même concentration, une solution de base faible est
moins basique qu'une base forte.
Force des acides et bases faibles
Il existe des tables qui indiquent la force des acides et des bases:
| Acide | Base |
Force |
| CH4 | CH3– | Acides négligeables Bases fortes |
|
NH3 |
NH2– |
|
|
H2O |
OH – |
|
|
HCO3– |
CO3– – |
Acides très faibles Bases faibles Acides faibles Bases très faibles |
|
NH4+ |
NH3 |
|
|
H2S |
HS – |
|
|
H2CO3 |
HCO3 – |
|
|
CH3COOH |
CH3COO– |
|
|
HNO2 |
NO2– |
|
| HF |
F – |
|
|
H3O+ |
H2O |
|
|
HNO3 |
NO3– |
Acides forts Bases négligeables |
| HCl |
Cl – |
|
|
H2SO4 |
HSO4– |
|
| HBr |
Br – |
|
| HI | I – |
On voit dans le tableau ci-dessus que certaines substances comme et H2O peuvent aussi bien capter que libérer un proton, on dit que ce sont des substances amphiprotiques.
On peut aussi prévoir la force d'un électrolyte en considérant la stabilité des ions formés:
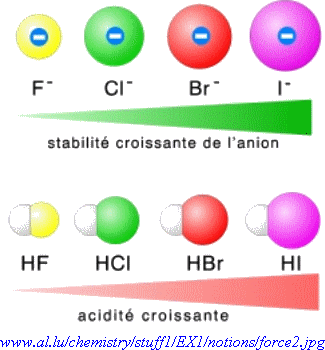 |
Par exemple I- est un gros anion, beaucoup plus stable que F-, il se forme donc plus facilement. Ainsi HI est un acide beaucoup plus fort que HF |
Exercice 1: Les
espèces suivantes sont-elles acides, basiques ou
amphiprotiques en solution aqueuse:
a) H2O
b) CH3NH2
c) PO43-
d) C6H5NH3+

Exercice 2: Ecrire les deux équilibres de transfert de
proton qui
montrent le caractère amphiprotique de:
a) HCO3-
b) HPO42-
Identifier aussi les couples conjugués acide-base dans chaque équilibre.
