 Acides, bases
et pH - pH des solutions tampons
Acides, bases
et pH - pH des solutions tampons
Logiciels et bibliographie
Programme d'étude
Cours
Acides, bases et pH
- Les diverses théories
- Acides et bases conjugués
- La notion de pH
- Cas de l'eau
- Mesure du pH
- Acides et bases forts
- Acides et bases faibles
- Hydrolyse des sels
- Solutions tampons
- Titrage acide-base
- Constante de dissociation*
- pKa des solutés*
- Calcul du pH*
- pH des acides et bases faibles seuls*
- pH des ampholytes*
- pH des solutions tampons*
- Formules et table pKa*
- Exercices*
HA
+ H2O
 H3O+
+ A-
H3O+
+ A- |
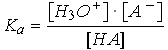 |
Nous
avons [A - ] 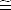 Cb
et [HA] Cb
et [HA] 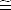 Ca
donc Ca
donc |
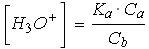 |
donc pH = pKa + log (Cb / Ca)
Variation du pH d'une solution tampon
Le log de la fraction varie peu si on varie les concentrations Ca et Cb :
Soit une mélange équimolaire de NH4+ et de NH3
- Le calcul du pH du mélange tampon est le
suivant : pH = 9,2
+ log 1 = 9,2
A ce point particulier, nous avons donc pH = pKa
Une adjonction accidentelle (ou non) d'une petite quantité de H3O+ ou de OH - ne modifie guère la valeur du pH:
- Par exemple, si on ajoute 10% de OH- au mélange (ce qui est déjà beaucoup) le pH varie de moins d'un dixième d'unité): pH = 9,2 + log (110/90) = 9,287
Les tampons sont donc utilisés comme stabilisateurs de pH (certaines réactions doivent se dérouler à un pH déterminé), et comme étalon de pH (étalonnage des pH-mètres). Ils ont aussi une grande importance biologique, le bon fonctionnement de l'organisme dépend d'un pH stable (le pH du sang ne doit pas varier de plus de quelques dixièmes d'unités pH.
Exercices
Exercice 1: Calculer
le pH d'une
solution contenant
0,1 mol/L d'acide
acétique et 0,01 mol/L d'acétate de sodium
dans un litre. (Ka de la paire CH3COOH/CH3COO-
est de 1,74 · 10-5)

Exercice 2: Calculer le pH d'une solution contenant
0,1 M de NH3
et 0,01 mol/L de NH4Cl dans 3 litres.
(Ka de la paire NH4+/NH3 est de 6 ·10-10)

Exercice 3: On prépare une solution tampon
en mettant dans un
bécher 50 ml de NH3 1mol/L
et 50 ml de NH4Cl 1mol/L
(le pKa de la
paire NH4+/NH3
est de 9,26).
a) Calculer le pH de
cette solution
b) On ajoute à cette solution
150
ml de NaOH 0,1M.
Quel est le pH obtenu?

Exercice
4: On titre 25.00 mL de HF 0.100 mol/L par NaOH 0.1
mol/L. Quel sera le pH de la solution après l'ajout de 23 mL de NaOH?

Exercice
5: Une solution tampon est obtenue en mettant dans un
récipient 15.0
g d'hypochlorite de potassium et 50.0 mL d'une solution d'acide
hypochloreux 1.000 mol/L puis en complétant ensuite à 500 mL.
Déterminer le pH de la solution obtenue.
