 Acides, bases
et pH - Mesure du pH
Acides, bases
et pH - Mesure du pH
Logiciels et bibliographie
Programme d'étude
Cours
Acides, bases et pH
- Les diverses théories
- Acides et bases conjugués
- La notion de pH
- Cas de l'eau
- Mesure du pH
- Acides et bases forts
- Acides et bases faibles
- Hydrolyse des sels
- Solutions tampons
- Titrage acide-base
- Constante de dissociation*
- pKa des solutés*
- Calcul du pH*
- pH des acides et bases faibles seuls*
- pH des ampholytes*
- pH des solutions tampons*
- Formules et table pKa*
- Exercices*
Il est plus simple de mesurer le pH d'une solution que de le calculer. Deux méthodes sont couramment utilisées.
a) Indicateurs colorés
Ce sont des colorants naturels ou synthétiques dont la
couleur
varie selon le pH du milieu dans lequel ils se trouvent. Ils
possèdent chacun un domaine de pH particulier appelé intervalle
de virage dans lequel ils changent de couleur
progressivement.
Ainsi pour le bleu de bromothymol (BBT) et la
phénolphtaleïne (PP) :
BBT jaune –> 6,0 –––––– 7,6 –––––––>
bleu
PP incolore ––––> 8,2 –––– 10,0 ––––>
rose (fuchsia)
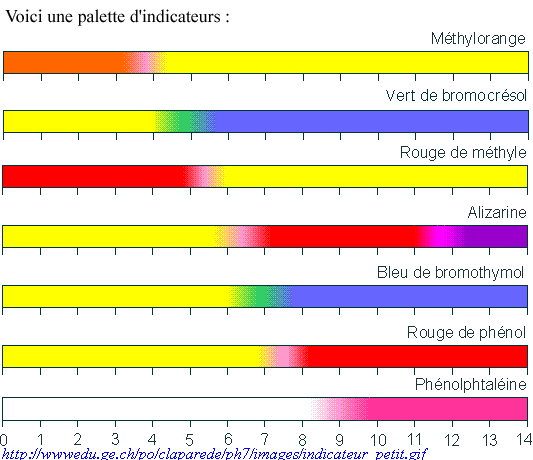 |
Il existe un grand nombre
d'indicateurs dont les
intervalles de virage sont différents. On utilise souvent un indicateur universel qui est un mélange de plusieurs indicateurs et dont la couleur varie en de façon continue avec le pH. |
b) Electrode de verre.
 |
Il s'agit d'un dispositif électrochimique qui produit une certaine tension électrique en fonction du pH de la solution. Il suffit de mesurer cette tension et de la convertir en une valeur de pH. |