 Acides, bases
et pH - cas de l'eau
Acides, bases
et pH - cas de l'eau
Logiciels et bibliographie
Programme d'étude
Cours
Acides, bases et pH
- Les diverses théories
- Acides et bases conjugués
- La notion de pH
- Cas de l'eau
- Mesure du pH
- Acides et bases forts
- Acides et bases faibles
- Hydrolyse des sels
- Solutions tampons
- Titrage acide-base
- Constante de dissociation*
- pKa des solutés*
- Calcul du pH*
- pH des acides et bases faibles seuls*
- pH des ampholytes*
- pH des solutions tampons*
- Formules et table pKa*
- Exercices*
La plupart des solutions sont préparées avec de l'eau comme solvant, ce liquide est donc très important.
H2O
 H+
+ OH- H+
+ OH- |
L'eau est susceptible de donner un cation H+. |
|
H2O
+ H+ |
L'eau est susceptible d'accepter un cation H+. |
L'eau peut donc se comporter comme une base et comme un acide (on appelle de telles substances des ampholytes)
Ces deux réactions ont lieu de manière plus au moins intense selon la (les) substance(s) dissoute(s) dans l'eau. Mais elles ont aussi lieu dans l'eau pure:
2 H2O
 H3O+ + OH-
et on
a
H3O+ + OH-
et on
a |
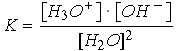 |
| Comme [H2O] = Cste on obtient : | [H3O+] · [OH-] = Cste = 10-14 à 25°C |
Cette constante Ke est appelée produit ionique de l'eau.
Dans
l'eau pure on a donc: [H3O+]
= [OH-] =
10-7 mol/L et
pH = 7 (à 25°C)
(à la température ambiante, il y a ainsi environ une
molécule dissociée sur 555 millions).
Ke = [H3O+] · [OH–] = 10–14 à 25°C
Limites théoriques d'acidité et de basicité des solutions aqueuses
La concentration de l'eau pure vaut 1000/18 = 55.55 mol/L, donc:
- Si un soluté acide transformait toutes les molécules d'eau en H3O+, on aurait un maximum de concentration en H3O+ proche de 55.55 mol/L en solution acqueuse, donc un pH de -1.74.
- Si un soluté basique transformait toutes les molécules d'eau en OH-, on aurait une maximum de concentration en OH- proche de 55.55 mol/L en solution acqueuse, donc un pH de 15.74.

Exercice 2: Calculer la molarité de OH-
dans une solution où
la concentration de H3O+
est:
a) 3.1 · 10-2M
b) 1.0 · 10-4
M
c) 0.20 M

Exercice 3: La valeur de Ke pour l'eau à la température du
corps (37°C)
est 2,5 · 10-14.
(a) Quelle est la molarité des ions H30+
et le pH de
l'eau neutre à 37°C ?
(b) Quelle est la molarité des ions OH- dans
l'eau neutre à 37°C ?

Exercice 4: On a mesuré le pH de plusieurs solutions dans
le
laboratoire de recherche d'une firme alimentaire ; indiquer pour chaque
valeur
du pH la molarité des ions H30+
:
(a) 3,3 (pH d'un jus d'orange acide) ; (b) 6,7 (pH d'un échantillon de
salive)
; (c) 4,4 (pH d'une bière) ;
(d) 5,3 (pH d'un échantillon de café), (e) Classez ces échantillons par
ordre
d'acidité croissante.
