 Acides, bases
et pH - Constante de dissociation
Acides, bases
et pH - Constante de dissociation
Logiciels et bibliographie
Programme d'étude
Cours
Acides, bases et pH
- Les diverses théories
- Acides et bases conjugués
- La notion de pH
- Cas de l'eau
- Mesure du pH
- Acides et bases forts
- Acides et bases faibles
- Hydrolyse des sels
- Solutions tampons
- Titrage acide-base
- Constante de dissociation*
- pKa des solutés*
- Calcul du pH*
- pH des acides et bases faibles seuls*
- pH des ampholytes*
- pH des solutions tampons*
- Formules et table pKa*
- Exercices*
L'équilibre de dissociation d'un acide dans l'eau s'écrit :
HA
+ H2O  H3O+
+ A-
H3O+
+ A- |
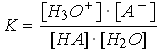 |
| En solution diluée, [H2O] est constante, donc | 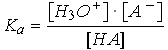 |
Ka est la constante de dissociation de l'acide HA. Plus l'acide est fort, plus la valeur de Ka est grande.
Pour la base conjuguée, on a l'équilibre :
A-
+ H2O
 AH + OH
-
AH + OH
- |
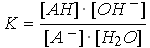 |
| En solution diluée, [H2O] est constante, donc | 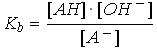 |
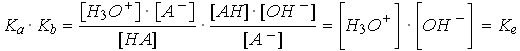
Ka et Kb sont liés par la relation Ka · Kb = Ke
Les valeurs de K sont très variables et on utilise l'échelle logarithmique: pKa = - log Ka
et on obtient: pKa + pKb = 14 (dans H2O à 25°C)
Conséquences pour les acides en solutions aqueuses
On a vu que l'eau est un ampholyte:
- si elle se trouve sous forme de H3O+, alors Ka = 55.55 mol/L, donc pKa = - 1.74
- si elle se trouve sous forme de OH - , alors Kb = 55.55 mol/L, donc pKb = - 1.74 et pKa = 15.75
Donc
Les acides dont le pKa est inférieur à –1,74 sont plus forts que H3O+. En solution aqueuse ils seront donc entièrement dissociés (= nivellement).
De même au-dessus d'un pKa de 15,74 (pKb = -1,74) les bases sont entièrement dissociées car plus fortes que OH- (= nivellement).
Tableau
de quelques pKa: 
Exercice 1: Déterminer les concentrations en H3O+
et OH- de:
a) C6H5COOH 0.2M
(pKa = 4.19)
b) NH2NH2
0.2M (Hydrazine) (pKb = 5.77)
c) (CH3)3N 0.2 M
(pKb = 4.19)
