 Acides, bases
et pH - pH des acides et bases faibles seuls
Acides, bases
et pH - pH des acides et bases faibles seuls
Logiciels et bibliographie
Programme d'étude
Cours
Acides, bases et pH
- Les diverses théories
- Acides et bases conjugués
- La notion de pH
- Cas de l'eau
- Mesure du pH
- Acides et bases forts
- Acides et bases faibles
- Hydrolyse des sels
- Solutions tampons
- Titrage acide-base
- Constante de dissociation*
- pKa des solutés*
- Calcul du pH*
- pH des acides et bases faibles seuls*
- pH des ampholytes*
- pH des solutions tampons*
- Formules et table pKa*
- Exercices*
Pour un acide faible seul
HA
+ H2O
 H3O+
+ A-
H3O+
+ A-Co - x x x |
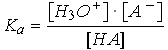 |
En négligeant l'autoprotolyse de l'eau, on a [H3O+] = x et Ka = x2 / (Co - x)
Comme l'acide est faible, on fait
l'approximation : Co
>> x
donc (Co - x) 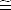 Co
Co
On remplace et on obtient : Ka · Co = x2 = [H3O+]2
D'où 2 · log ([H3O+]) = log Ka + log Co ce qui entraîne pH = 1/2 pKa - 1/2 log Co
Exemple :
Calculons le pH d'une solution de HCN 0,1 mol/L (pKa = 9.4)
pH = 1/2 pKa - 1/2 log Co ce qui donne pH = 5,19
Attention: L'approximation faite, Co >> x n'est plus très valable si Ka > 10-3 donc pour des pKa < 3, il faut alors faire le calcul sans cette approximation.
Pour une base faible seule
A-
+
H2O
 AH +
OH -
AH +
OH -Co - x x x |
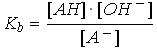 |
En négligeant l'autoprotolyse de l'eau, on a [OH -] = x et Kb = x2 / (Co - x)
Comme la base est faible, on
fait l'approximation : Co
>> x
donc (Co - x) 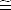 Co
Co
Par remplacement dans la formule, on obtient :
Kb · Co = [OH-]2 en remplaçant [OH-] = Ke / [H3O+] et Kb = Ke / Ka
On obtient Ke · Co = Ka · (Ke / [H3O+])2 ce qui se simplifie: [H3O+]2 = Ka · Ke / Co
D'où pH = 7 + 1/2 pKa + 1/2 log Co
Exemple:
Calculons le pH d'une solution de NH3 0,001 mol/L (pKa = 9.22)
pH = 7 + ½ · 9.22 + ½ · log(0.001) ce qui donne pH =10,11
Attention: L'approximation faite, Co >> x n'est plus très valable si Kb > 10-3 donc pour des pKb < 3, il faut alors faire le calcul sans cette approximation.
Limite des approximations
Pour que les formules soient valables, il faut que le degré de dissociation de l'espèce soit inférieur à 5 %. Par exemple, pour le calcul du pH de CH3COOH 0.001M:
Avec la formule pH = 1/2 pKa - 1/2 log Co On obtient: pH = 2.38 + 1.5 = 3.88
Contrôle du degré de ionisation: -log [H3O+] = 3.88 donc [H3O+] = 1.318 · 10-4
% de ionisation = ( 1.318 · 10-4 / 0.001 ) · 100 = 13. 8 %
L'approximation n'est pas valable et il faut faire le raisonnement complet:
|
Espèces: |
CH3COOH |
H3O+ |
CH3COO- |
|
Etape 1: Molarité initiale |
0.001 |
0 |
0 |
|
Etape 2: Variation |
- x |
+ x |
+ x |
|
Etape 3: Molarité à l'équilibre |
0.001 – x |
x |
x |
Etape 4: Introduire dans la constante d'acidité:
Ka = 1.8 · 10-5 = x2 / (0.001 – x)
x2 + 1.8 · 10-5 x – 1.8 · 10-6 = 0 Solution : 0.00012547 (et -0.00014347 à éliminer)
pH = - log x = 3.90 On voit que l'erreur est ici encore très faible ! (ce qui n'est plus du tout le cas avec des pKa proches de zéro)
Exercices
Exercice 1: Quel est le pH d'une solution aqueuse
renfermant 3 g
d'acide acétique (CH3COOH, pKa
= 4,78) par litre ?

Exercice 2: Quel est le pH d'une solution aqueuse
renfermant 1,38 g de
nitrite de sodium (NaNO2) par litre ?
On connaît pKa (HNO2)
= 3,3.

Exercice 3: Soit HNO2 (pKa = 3,3)
M/10, quel est le pH de cette solution ?

Exercice 4: Une solution de HNO2
0,2 M a un
pH de
2,02. Quelle est la valeur de son Ka?

Exercice 5: Une solution de fluorure de potassium
(KF)
a un pH de
8, quelle est la
concentration de KF (M et g/l) ? On
connaît
le pKa (HF) = 3,2.

Exercice 6: Une solution d'acide hypochloreux (HClO, pKa = 7,5) a un pH de 4,5. Quelle est la concentration de l'acide hypochloreux en M et en g/l ?
Exercice 7: Le
pH d'une solution de HClO2 0.1 M est de 1.2.
Quelles sont les valeurs du Ka et du pKa de l'acide chloreux?

Exercice 8: Calculer
le pH des solutions suivantes:

a) HCOOH 0.2M
(pKa = 3.75)
b) NH2NH2
0.12M
(Hydrazine)
(pKb = 5.77)
c) C6H5COOH 0.15M
(pKa = 4.19) d)
C10H14N2
0.0034M (la nicotine, une base)
(pKb =
5.98)
Exercice 9: Le pH d'une solution de C3H7NH2
0.1 M est de 11.86. Quelles sont les valeurs du Kb et du pKb de la
propylamine?

Exercice 10: On met 1 g de HIO3 dans
un litre d'eau, calculer le pH de trois manières :
a) Avec la formule des acides faibles.
b) En considérant que c'est un acide fort.
c) Sans faire l'approximation que la dissociation de l'acide est faible.
