 Acides, bases
et pH - pKa des solutés
Acides, bases
et pH - pKa des solutés
Logiciels et bibliographie
Programme d'étude
Cours
Acides, bases et pH
- Les diverses théories
- Acides et bases conjugués
- La notion de pH
- Cas de l'eau
- Mesure du pH
- Acides et bases forts
- Acides et bases faibles
- Hydrolyse des sels
- Solutions tampons
- Titrage acide-base
- Constante de dissociation*
- pKa des solutés*
- Calcul du pH*
- pH des acides et bases faibles seuls*
- pH des ampholytes*
- pH des solutions tampons*
- Formules et table pKa*
- Exercices*
- Les acides et bases
forts sont entièrement
dissociés dans les solutions aqueuses diluées (il n'y a pas de
molécules HCl en solution aqueuse diluée, tout se trouve sous la
forme H3O+ et Cl-). Ce
phénomène est appelé nivellement
des acides et
bases fortes.
- Les acides et bases indifférents sont plus faibles que la molécule H2O et ne peuvent ni lui donner, ni lui prendre un cation H+. Ils seront par conséquent sans effet sur le pH des solutions aqueuses.
Déplacement des
équilibres acide-base
Tableau
de quelques pKa: 
L'acide le plus fort donnera son proton, ainsi si on considère l'équilibre:
CH3COOH + NH3
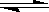 CH3COO-
+ NH4+
CH3COO-
+ NH4+
Il est déplacé vers la droite car CH3COOH (pKa
= 4.76) est un acide plus fort que NH4+
(pKa = 9.22 ).
Au contraire, l'équilibre :
CH3COOH + Cl-
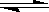 CH3COO-
+ HCl est
fortement déplacé vers la gauche.
CH3COO-
+ HCl est
fortement déplacé vers la gauche.
Exercices
Exercice 1: Sachant
que le Ka de l'acide acétique (CH3COOH)
est de 1,8 · 10-5 et de 3 · 10-8
pour l'acide
hypochloreux (HClO), déterminer laquelle est la base la plus forte, ClO-
ou CH3COO-?

Exercice 2: Donnez les valeurs de Ka et classer les acides
suivants par
ordre de force croissante :
(a) acide phosphorique H3PO4,
pKa1 = 2,12 ; (b) acide
phosphoreux H3PO3, pKa1 =
2,00 ;
(c) acide séléneux H2SeO3,
pKa1 = 2,46 ; (d) acide
sélénique H2SeO4, pKa1 =
1,92.

Exercice 3: (a) Ecrire les noms et les formules de la base
conjuguée la
plus forte et la plus faible des acides énumérés dans l'exercice
précédent
(b) Quelles sont les valeurs des Kb, de ces deux bases ?
(c) Quelle est la base qui, dissoute dans l'eau à une concentration
donnée,
donnera la solution ayant le pH le plus élevé ?

Exercice 4: En
broyant du carbonate de sodium (Na2CO3)
avec du chlorure d'ammonium (NH4Cl), obtient-on
une forte odeur d'ammoniac (NH3) ?
(Aide: on a l'équilibre: NH4+
+ CO32-
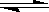 NH3
+ HCO3-
)
NH3
+ HCO3-
)

Exercice 5:
Le résultat de l'expérience de l'exercice précédent serait-il
le même si on avait broyé de l'hydrogénocarbonate (NaHCO3)
de sodium à la place du carbonante de sodium?
