 Acides, bases
et pH - Exercices
Acides, bases
et pH - Exercices
Logiciels et bibliographie
Programme d'étude
Cours
Acides, bases et pH
- Les diverses théories
- Acides et bases conjugués
- La notion de pH
- Cas de l'eau
- Mesure du pH
- Acides et bases forts
- Acides et bases faibles
- Hydrolyse des sels
- Solutions tampons
- Titrage acide-base
- Constante de dissociation*
- pKa des solutés*
- Calcul du pH*
- pH des acides et bases faibles seuls*
- pH des ampholytes*
- pH des solutions tampons*
- Formules et table pKa*
- Exercices*

Exercice 2: La valeur de Ke à 40°C
est de 3.8 · 10-14. Quel est
le pH de l'eau pure à 40 °C ?

Exercice 3: Le degré de ionisation d'une solution 0.110 M
d'acide
benzoïque est de 2.4%. Quels sont le pH et le Ka de l'acide benzoïque?

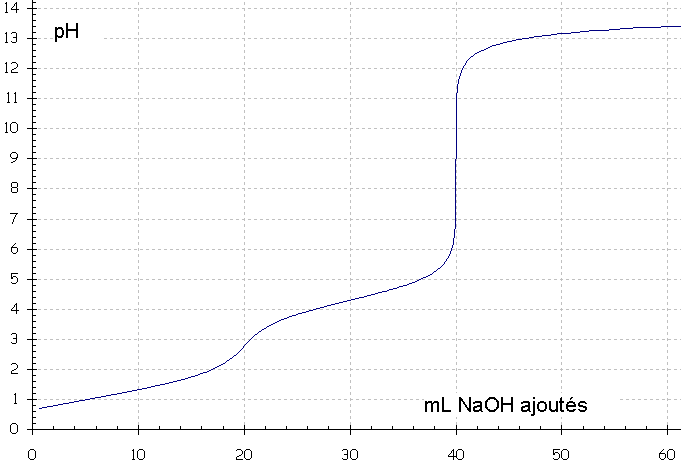
a) Déterminer graphiquement
le(s) pKa ainsi que le(s) pH au(x) P.E.
b) Proposer un acide
possible

Exercice 5: Calculer le pH des solutions des acides
diprotiques
suivants en ne négligeant la deuxième ionisation que lorsque
l'approximation
est justifiée:
a) H2CO3 0.0010 M
b) (COOH)2 0.1 M c) H2S
0.20 M

Exercice 6: Soit une solution 0.012 mol/l de
HF à laquelle on ajoute du
fluorure de sodium NaF à raison de x moles par litre. La
concentration des ions H+ est de 1.00 · 10-4
mol/l.
a) Ecrire en fonction de x l'équation d'équilibre de
cette solution.
b) Si on résout
l'équation obtenue, quelle valeur trouve-t-on pour x.
c)
Quelle est la concentration en NaF dans la solution HF – NaF ?

Exercice 7: Pour une base faible en solution, on a la formule:

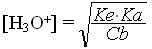 avec: Ke = produit ionique
de l'eau
Cb
= concentration de la base
avec: Ke = produit ionique
de l'eau
Cb
= concentration de la base
Trouver cette formule par un raisonnement clair et bien expliqué.
Exercice 8: Que signifie le terme "protolyse"?

Exercice 9: Quelle est la relation qui lie Ka et Kb pour
une paire
acide-base?

Exercice 10: Quelles sont les deux principales méthodes
expérimentales
permettant de déterminer le pH d'une solution?

Exercice 11: Pour un acide faible en solution, on a la formule:
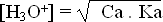 avec:
Ca = concentration de l'acide
avec:
Ca = concentration de l'acide
Trouver cette formule par un raisonnement clair et bien expliqué.
