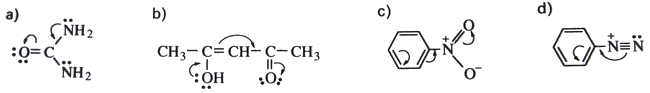Chimie
organique - structure électronique
Chimie
organique - structure électronique
Logiciels et bibliographie
Programme d'étude
Cours
Chimie organique
- Notations
- Forme des molécules
- Isomérie
- Groupes fonctionnels
- Nomenclature
- Réactions organiques
- Structure électronique
- Mécanisme réactionnel
- Réactions importantes
- Les hydrocarbures
- Les détergents
- Les polymères
- Composés aromatiques
- Les glucides
- Les lipides
- Les protéines
- Acides nucléiques
La forme de la molécule, l'électronégativité des atomes et la délocalisation des électrons sont lesfacteurs à considérer. Dans les sustances organiques, les atomes les plus fréquents sont C, H, O, N, on va s'intéresser plus spécialement à eux ci-dessous.
Forme des molécules
- Les atomes de C ont 4 électrons de valence, les atomes de C liés à 4 atomes sont peu réactifs (hybridation sp3) car difficiles a atteindre. Les atomes de C avec double (hybridation sp2) ou triple liaisons (hybridation sp) sont plus faciles à atteindre.
- Les atomes de N ont 5 électrons de valence, ce qui entraîne la présence d'un doublet libre très accessible.
- Les atomes de O ont 6 électrons de valence, ils sont faciles à atteindre, de plus, lié à H, il peut former un anion OH-.
- Les atomes de H ont 1 électron de valence, facile à atteindre, mais H ne peut se lier qu'à un atome.
Polarisation des liaisons
Electronégativité de : C: 2.55 H: 2.2 O: 3.44 N: 3.04 Halogènes: importanteLa différence d'électronégativité entre C et H est de 0.35, la délocalisation est donc faible. Par contre entre C et O, la différence est de 1.1, ce qui entraîne une délocalisation assez importante.
Les atomes de C liés à O se trouvent donc appauvris en électrons, les atomes de O très enrichis en électrons et les atomes de N ne sont que légèrement enrichis en électrons mais ils ont un doublet libre.
Quand il y a des atomes électronégatifs dans une molécule, ils déplacent le nuage électronique vers eux, on parle d'effet inductif.
Délocalisation des électrons
On peut parfois représenter une même molécule avec un placement des doubles liaisons différent: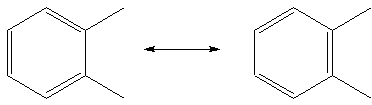 On parle de mésomérie
On parle de mésomérieIl n'y a aucune raison de préfèrer l'une ou l'autre, ce sont ici deux formes limites. L'existence de plusieurs représentations possibles donne une plus grande stabilité à la molécule car les électrons sont répartis uniforméments sur les 6 carbones (on peut aussi l'expliquer par la thermodynamique, le desordre, donc l'entropie est plus grande). Des doubles liaisons donne une bonne stabilité, on parle de liaisons conjuguées.
Un autre exemple dont les conséquences sont différentes:
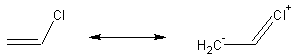 on
peut représenter par:
on
peut représenter par: 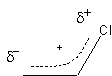
Ces deux formes possibles expliquent certaines propriétés de cette substance (le chlorure de vinyle peut réagir avec lui-même pour former le PVC, le polychlorure de vinyle).
Effet mésomère et effet inductif
Parfois ces deux effets vont dans le même sens, parfois ils s'opposent.effet mésomère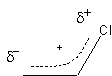 |
effet inductif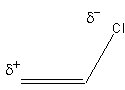 |
Pour le chlorure de vinyle (cas vu plus haut), l'effet mésomère est en opposition avec l'effet inductif. |
Quand ces deux effets sont en opposition ,gnéralement l'effet mésomère domine. Par exemple pour le monoxyde de carbone, contrairement à ce que l'on pourrait croire, il y a une légère charge positive sur l'oxygène:
Formes limites et représentation de l'effet
mésomère par une forme hybride:
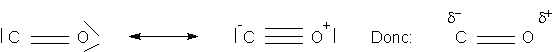
Stabilité des carbocations, carbanions et carbones avec électron célibataire
Dans les réactions organiques, il y a souvent un produit intermédiaire comportant un atome de carbone chargé ou avec un électron célibataire. On peut dire que:- Les carbocations sont mal stabilisés si les atomes liés sont des hydrogènes.
- Les carbanions sont bien stabilisés si les atomes liés sont des hydrogènes.
- Les carbones avec électrons célibataires sont mal stabilisés si les atomes liés sont des hydrogènes.
Règle de markownikoff: Lors d'une addition sur une double liaison, le groupe le plus électronégatif (nucléophile) se fixe sur le carbone ayant le moins d'hydrogènes liés.
Illustration: l'addition d'eau sur le propène donne de préférence l'alcool secondaire.
Exercices
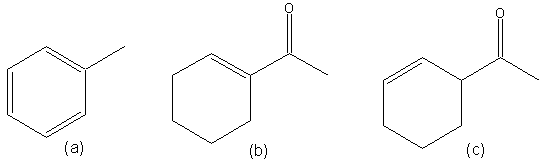
Exercice 1: parmi les structures ci-dessous, lesquelles sont des mésomères, lequelles sont des isomères?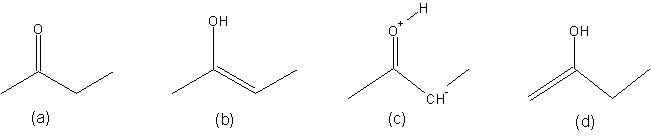

Exercice 2: Existe-t-il un effet mésomère dans les structures suivantes? si oui, dessiner l'autre forme limite.

Exercice 3: Existe-t-il un effet mésomère dans les structures suivantes? si oui, dessiner l'autre forme limite. L'alcool CH2=CH-CH2-CHOH-CH3 peut en principe par déshydratation donner soit:
CH2=CH-CH=CH-CH3 soit CH2=CH-CH2-CH=CH2. Cette réaction fournit préférentiellement la plus stable de ces deux substances, laquelle est-ce ?

Exercice
4*: La
force d'un acide organique est due à la facilité avec laquelle il peut
se séparer du H+. Entre l'acide
acétique CH3-COOH et l'acide chloroacétique CH2Cl-COOH,
lequel est le plus fort? 
Exercice 5*: La
fixation d'hydrogène sur une double liaison (hydrognation) est
exothermique. L'hydrogénation des deux isomères suivants: (a) CH2=CH-CH=CH-CH3
(b) CH2=CH-CH2-CH=CH2 ne dégagent pas la même
énergie, 226 kJ pour (a) et 254 kJ pour (b), expliquer cette
différence. 
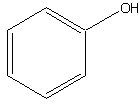

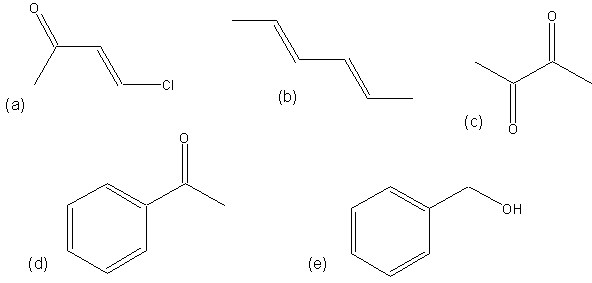
Exercice 7*: Pour les molécules ci-dessous, existe-t-il un effet mésomère? Si oui, dessiner la forme hybride.

Exercice 8*: Expliciter les formes hybrides obtenues en effectuant les déplacements électroniques ci-dessous: