 Chimie
organique - hydrocarbures
Chimie
organique - hydrocarbures
Logiciels et bibliographie
Programme d'étude
Cours
Chimie organique
- Notations
- Forme des molécules
- Isomérie
- Groupes fonctionnels
- Nomenclature
- Réactions organiques
- Structure électronique
- Mécanisme réactionnel
- Réactions importantes
- Les hydrocarbures
- Les détergents
- Les polymères
- Composés aromatiques
- Les glucides
- Les lipides
- Les protéines
- Acides nucléiques
- Les hydrocarbures saturés, pas de liaisons multiples. Ce sont les alcanes.
- Les hydrocarbures insaturés, au moins une liaison multiple. Ce sont les alcènes et les alcynes.
Les alcanes
Ce sont les constituants principaux du pétrole et du gaz naturel. À température ambiante et sous la pression atmosphérique, les alcanes linéaires sont :- Gazeux pour les quatre premiers (CH4 à C4H10). Le méthane est le constituant principal du gaz naturel, dans lequel il est le plus souvent accompagné d'éthane. Le propane (C3H6) et le butane (C4H10) sont souvent liquéfiés sous pression et transportés dans des bonbonnes.
- Liquides pour les chaînes de 5 à 12 carbones. ce sont les constituants principaux des carburants et des huiles de graissage.
- Solides s'il y a plus de 15 atomes de carbone. La paraffine utilisée pour fabriquer les bougies en est un exemple.
Exercice 1: Établir la formule permettant de calculer la masse molaire M(n) d'un alcane à n atomes de carbone.

Halogénation des alcanes et des cyclanes
Un ou des atomes d'hydrogène sont remplacés par d'autres atomes. Certains produits obtenus sont connus:.
CHCl3 trichlorométhane ou chloroforme (autrefois utilisé comme anesthésique car toxique).
CCl4 tétrachlorométhane ou tétrachlorure de carbone. Surtout utilisé, comme le CHCl3, pour la synthèse de dérivés chlorofluorés du méthane appelés fréons. Par exemple : CCl4 + 2HF
 CCl2F2
+ 2 HCl
CCl2F2
+ 2 HClCombustion des alcanes
Dans certaines conditions un mélange d'alcane et d'oxygène peut s'enflammer. Cette réaction de combustion est très exothermique :
CH4 + 2O2
 CO2 +
2H2O
CO2 +
2H2O
Si le mélange des gaz est proche de la stoechiométrie de la réaction, celle-ci peut même être explosive.
Exercice 2: Soit la combustion d’un alcane avec O2 . La combustion complète d'un volume V d'alcane gazeux nécessite un volume 5 fois plus grand de dioxygène. Les deux volumes de gaz sont mesurés dans les mêmes conditions de température et de pression.
a) Donner la formule et le nom de cet alcane.
b) Quels produits obtient-on par monobromation de celui-ci?

Exercice 3: Les recharges de camping-gaz pour randonneurs contiennent 90 g de butane.
a) Calculer la quantité de butane contenu dans la recharge.
b) Calculer le volume qu'occuperait cette quantité à 25°C et sous une pression de 1 atmosphère.
c) Quel est le volume d'air nécessaire, dans ces mêmes conditions de température et de pression pour permettre la combustion complète de tout le gaz contenu dans la recharge ? On considère un rendement de combustion de 100 %.

Exercice 4: La combustion complète de 6 cm3 d'un mélange d'éthane et de butane fournit 16 cm3 de dioxyde de carbone, les deux volumes étant mesurés dans les mêmes conditions de température et de pression. Calculer la composition molaire du mélange, sa densité et le volume de dioxygène nécessaire à sa combustion complète.

Exercice 5: La combustion complète de 3,6 g d'un alcane donne 11 g de dioxyde de carbone et 5,4 g d'eau.
a) En déduire la formule brute de l'alcane.
b) Sachant que la monochloration de cet alcane ne donne qu'un seul produit, déterminer sa formule topologique et son nom.

Moteurs à explosions
Dans un moteur à explosion, l’énergie thermique dégagée par la combustion du carburant est transformée en énergie mécanique transmise au vilebrequin.
Principe de fonctionnement du moteur à essence à quatre temps :
- À la sortie du gicleur, l'essence est dispersée en fines gouttelettes dans de l'air.
- Ce brouillard pénètre dans le cylindre pendant l'admission.
- Le mélange air-carburant est ensuite comprimé rapidement, ce qui provoque une augmentation de sa température.
- À la fin du temps de compression, une étincelle est produite entre les deux électrodes de la bougie et déclenche la réaction de combustion du mélange alcane-air.
L'essence, ordinaire ou super, est un mélange essentiellement constitué d'alcanes linéaires ou ramifiés possédant sept, huit ou neuf atomes de carbone. L'expérience montre que le taux de compression que peuvent supporter, sans auto-inflammation, les alcanes ramifiés est supérieur à celui que supportent les isomères linéaires. La résistance à l'auto-inflammation d'un mélange air-carburant est caractérisée par son indice d'octane (I.O.).
Un mélange d'heptane CH3—(CH2)5—CH3 et d'air explose très facilement lors de la compression ; on lui assigne une valeur 0 pour indice d'octane. Le triméthyl-2,2,4 pentane, (CH3)3C—CH2—CH(CH3)2, souvent appelé «isooctane», résiste fortement à l'auto-inflammation; on lui assigne la valeur 100 pour indice d'octane.
Une essence a pour indice d'octane n si son comportement à l'auto-inflammation est identique à celui d'un mélange constitué de n volumes d' « isooctane » et (100-n) volumes d'heptane. L'essence « ordinaire » a un indice d'octane voisin de 95, alors que l'essence « super » a un indice supérieur à 98. Pour améliorer l'indice d'octane d'un carburant on peut augmenter la proportion d'alcanes ramifiés, ce qui suppose des opérations de reformage assez coûteuses.
Les alcènes
Les liaisons simples peuvent tourner autour d'elle-même, alors que les doubles liaisons sont rigides. Une molécule d'éthylène, par exemple, est donc une molécule plane.On peut faire des réactions d'addition sur les alcènes, par exemple :
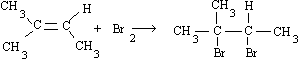
2-méthyl-2-butène 2,3-dibromo-2-méthyl-butane
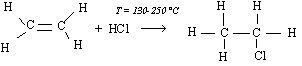
Le chloroéthane ainsi obtenu sert surtout à la fabrication du tétraéthyl de plomb.
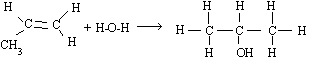
L'hydratation du propène donne essentiellement du propanol-2 (mais aussi du propanol-1 en moindre proportion). C'est une méthode de préparation des alcools.
Les alcynes
La liaison triple provoque l’alignement de trois liaisons sur une même droite.L'alcyne le plus utilisé dans l’industrie est l'éthyne, appelé aussi acétylène, C2H2. À température et pression ordinaire c'est un gaz. Il est instable et se décompose violemment dès que la température s'élève ou que sa pression augmente
90% de l'acétylène utilisé provient du pétrole mais on peut aussi l'obtenir en laboratoire par action de l'eau sur le carbure de calcium :
CaC2 + 2H2O
 C2H2
+ Ca(OH)2 (lampes pour spéléologues)
C2H2
+ Ca(OH)2 (lampes pour spéléologues)
On peut réaliser beaucoup de réactions à partir de l'acétylène, par exemple en additionnant à l'acétylène des composés de type H-Z (où Z est un non-métal) , on obtient des dérivés vinyliques (on appelle vinyle le groupe H2C = CH ·) utiles pour la synthèses des polymères vinyliques.
Exercice 6:
Dessiner la structure des molécules de propane, de
propène
et de propyne, et donner les formules brutes et les formules
semi-développées .
.
Exercice 7:
Combien de molécules s’appellent-elles
chlorométhylpropane? Dessiner ces molécules
