Chimie
organique - formes des molécules
Chimie
organique - formes des molécules
Logiciels et bibliographie
Programme d'étude
Cours
Chimie organique
- Notations
- Forme des molécules
- Isomérie
- Groupes fonctionnels
- Nomenclature
- Réactions organiques
- Structure électronique
- Mécanisme réactionnel
- Réactions importantes
- Les hydrocarbures
- Les détergents
- Les polymères
- Composés aromatiques
- Les glucides
- Les lipides
- Les protéines
- Acides nucléiques
- Atome de carbone lié à 2 atomes: angle de 180°
- Atome de carbone lié à 3 atomes: angles de 120°
- Atome de carbone lié à 4 atomes: angles de 109°
En plus, pour des raisons d'arrangement des électrons entre les atomes (orbitales), quand deux atomes de carbone sont liés par une double liaison, cela fixe les atomes sur un plan.
Ainsi CH2=CH2 est une molécule plane et rigide, CH3 - CH3 , par contre, occupe un gros volume et les atomes d'hydrogène peuvent tourner autour de l'axe formé par la liaison C - C.
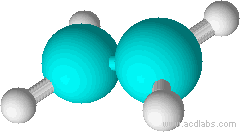 |
CH2=CH2 est une molécule plane et rigide. |
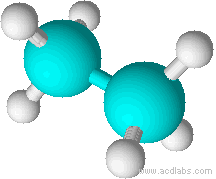 |
CH3 - CH3 est une molécule non plane et les atomes d'hydrogène peuvent tourner autour de l'axe formé par la liaison C - C. |
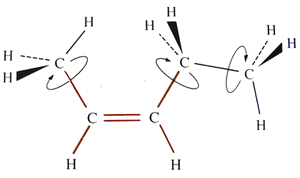 |
Dans une chaîne carbonée, une double liaison constitue un maillon rigide et plan. |
Exercice 1: dessiner et estimer les angles de liaisons dans une molécule de CH3 - CH2OH (éthanol).

Exercice 2: dessiner et estimer les angles de liaisons dans une molécule cyclique formée de 6 carbones et 6 hydrogènes: