Chimie
organique - réactions organiques
Chimie
organique - réactions organiques
Logiciels et bibliographie
Programme d'étude
Cours
Chimie organique
- Notations
- Forme des molécules
- Isomérie
- Groupes fonctionnels
- Nomenclature
- Réactions organiques
- Structure électronique
- Mécanisme réactionnel
- Réactions importantes
- Les hydrocarbures
- Les détergents
- Les polymères
- Composés aromatiques
- Les glucides
- Les lipides
- Les protéines
- Acides nucléiques
Si l'on considère l'état initial et final, on peut classer les réactions organiques en 4 (5 si on considère la combustion) catégories:
- Réaction de
substitution Un atome ou un groupe d'atomes est remplacé
par un autre.
Exemple: Lors de l'action du chlore sur l'éthane, on substitue à un atome d'hydrogène un atome de chlore avec formation en parallèle d'acide chlorhydrique:
C2H6 + Cl2 C2H5Cl ( Chloroéthane) + HCl
C2H5Cl ( Chloroéthane) + HCl
Quand deux molécules se lient avec le départ d'une molécule d'eau, on dit que c'est une réaction de condensation, même si formellement c'est une substitution:
R-COOH + R'-NH2 R-CO-NH-R'
+ H2O
R-CO-NH-R'
+ H2O
- Réaction
d'addition On ramène une double ou triple liaison à une
simple,
ceci en fixant sur les valences disponibles des atomes ou des groupes
d'atomes. Une réaction de ce type est dite d'addition car on
additionne ainsi des atomes.
Exemples: C2H4 + H2O C2H5OH
CH2
= CH2 + H2O
C2H5OH
CH2
= CH2 + H2O  CH3
- CH2OH
CH3
- CH2OH
- Réaction
d'élimination Par perte de deux atomes, on crée un
deuxième lien
de covalence entre deux atomes de carbone, augmentant ainsi le degré
d'insaturation.
Exemple: CH3- CHOH - CH3 H2O + CH2
= CH - CH3
H2O + CH2
= CH - CH3 - Réaction de réarrangement (ou
transposition) Certains atomes ou groupes d'atomes
changent de place dans la molécule.
Exemple: CH2=CHOH CH3-CHO
CH3-CHO - (Réaction de
combustion) La combustion conduit à la
destruction de la molécule pour former du gaz carbonique et de l'eau.
Exemple: CH4 + 2 O2 CO2
+ 2
H2O
CO2
+ 2
H2O
Beaucoup de ces réactions peuvent être considérées comme des réactions redox.
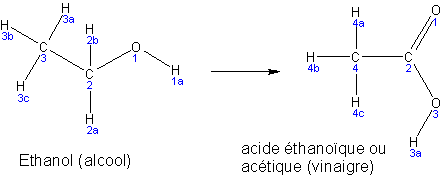
Par exemple l'alcool peut se transformer en vinaigre par oxydation :
|
|
Le carbone 2 de
l'alcool est au degré d'oxydation -1 Le carbone 2 du vinaigre est à +3 Il perd donc 4 électrons et est oxydé. (voir chapitre sur les réactions redox pour la détermination des n.o.) |
Une réaction organique obéit aux mêmes règles que les
réactions en chimie minérales. On peut cependant dire qu'en général:
- Elles ont une vitesse assez lente.
- Elles ont une enthalpies de réactions faibles.
- Elles sont souvent réversibles.
- Les produits de réaction sont souvent multiples.
- Les conditions de réaction ont beaucoup d'importance.
Exercice 1:
Quelle proportion de CH4
et d’O2
utiliser pour que la réaction de combustion soit
stoechiométrique ? 
Exercice 2:
Ecrire l'équation de réaction
de combustion du propane (C3H8).
Pourquoi faut-il modifier le réglage
d'admission d'air des brûleurs à gaz lorsque le propane
est remplacé par du gaz naturel (~ méthane pur) ? 
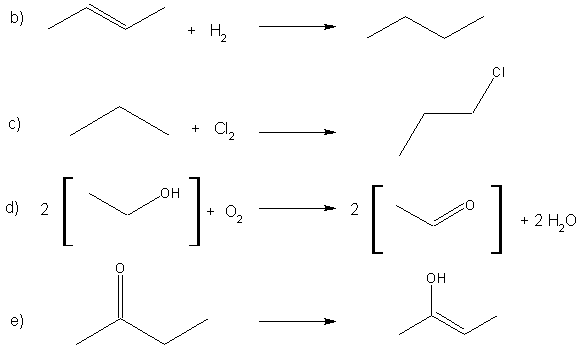
Exercice 3: Pour
chacune des réactions ci-dessous, trouver à quelle catégorie elle
appartient et déterminer s'il s'agit d'une réaction de réduction ou
d'oxydation.
a) NaOH + CH3-Br
 CH3-OH
+ NaBr
CH3-OH
+ NaBr