Chimie
organique - mécanisme réactionnel
Chimie
organique - mécanisme réactionnel
Logiciels et bibliographie
Programme d'étude
Cours
Chimie organique
- Notations
- Forme des molécules
- Isomérie
- Groupes fonctionnels
- Nomenclature
- Réactions organiques
- Structure électronique
- Mécanisme réactionnel
- Réactions importantes
- Les hydrocarbures
- Les détergents
- Les polymères
- Composés aromatiques
- Les glucides
- Les lipides
- Les protéines
- Acides nucléiques
On distingue trois types de réactifs:
- Les
radicaux, produit issus de la séparation d'une molécule
avec partage des électrons:
A-B A· + B· ce partage équitable
se passe en
général entre deux atomes de même électronégativité, par exemple: Cl2
A· + B· ce partage équitable
se passe en
général entre deux atomes de même électronégativité, par exemple: Cl2
 Cl·
+ Cl· ou entre deux carbones d'hydrocarbures
saturés.
Cl·
+ Cl· ou entre deux carbones d'hydrocarbures
saturés.
Ces réaction se font surtout en phase gazeuse. - Les
électrophiles, ce sont des atomes ou groupes d'atomes qui
ont besoin pour se lier d'un doublet fourni par l'autre ractif:
CH3-Br + OH- CH3-OH
+ Br- le carbone
de CH3 est appauvrit en électron par sa liaison
avec le Brome qui est électronégatif, il attire donc le doublet
disponible de OH-.
CH3-OH
+ Br- le carbone
de CH3 est appauvrit en électron par sa liaison
avec le Brome qui est électronégatif, il attire donc le doublet
disponible de OH-. - Les
nucléophiles,
ce sont des atomes ou groupes d'atomes qui fournissent un doublet
d'électron à l'autre reactif. Dans la réaction vue plus haut:
CH3-Br + OH- CH3-OH
+ Br- on peut
considérer OH- comme un réactif nucléophile.
Comme pour les réaction redox, cela dépend de la substance que l'on
considère!
CH3-OH
+ Br- on peut
considérer OH- comme un réactif nucléophile.
Comme pour les réaction redox, cela dépend de la substance que l'on
considère!
- Solvant non polaire, ne joue aucun rôle chimique. Par exemple les hydrocarbures saturés.
- Solvant protique, molécule polaire contenant des H lié à des atomes électronégatifs. Par exemple l'eau, l'alcool.
- Solvant polaire aprotique, molécule poaire mais sans H détachable, par exemple CH3CN.
Illustration
En milieu acide, les alcools peuvent "partir" facilement sous forme de OH- (rupture de la liason C-O), par contre en milieu basique, ils perdent facilement le "H" par la rupture de la liaison O-H. En milieu neutre ils sont peu réactifs.alcool en milieu basique
CH3-CH2OH + B
 CH3-CH2O-
+ BH+ (B
représente une base)
CH3-CH2O-
+ BH+ (B
représente une base)puis une substitution nucléophile par attaque du carbone appauvri en électrons de CH3Br:
CH3-CH2O- + CH3Br
 CH3-CH2-O-CH3
+ Br-
CH3-CH2-O-CH3
+ Br-Alcool en milieu acide
CH3-CH2OH + HCl
 CH3-CH2Cl
+ H2O
CH3-CH2Cl
+ H2O
Les grandes classes de mécanisme |
| Substitution radicalaire |
Initiation:
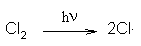 Propagation: Cl· + CH4  CH3·
+ HCl et
CH3· +
Cl2 CH3·
+ HCl et
CH3· +
Cl2  CH3Cl
+ Cl· CH3Cl
+ Cl·Terminaison: rencontre de deux radicaux, par exemple: 2Cl·  Cl2 Cl2 |
| Addition radicalaire |
| Par exemple l'addition des halogènes sur le benzène |
| Polymérisation radicalaire |
| Par exemple la formation du polychlorure de vinyle (PVC) à partir du chlorure de vinyle (voir chapitre sur les polymères) |
| Substitution nucléophile (SN1 si 2 étapes, SN2 si 1 étape) |
Sur un carbone saturé: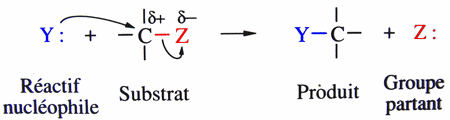 Sur un carbonyle: 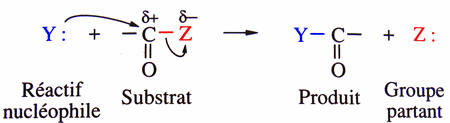 en fait, il y a deux étapes: 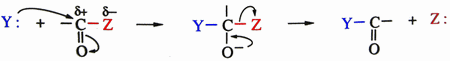 Sur un cycle benzénique: 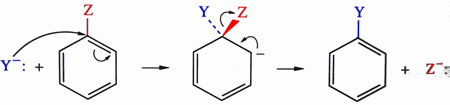 |
| Substitution électrophile |
Sur un carbone saturé: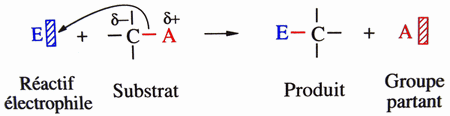 Sur un cycle aromatique: 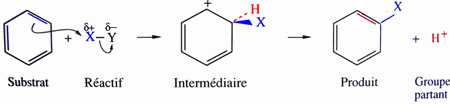 |
| Addition électrophile |
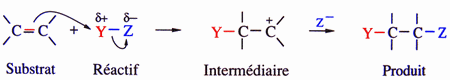 |
| Addition nucléophile |
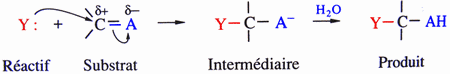 |
| Elimination |
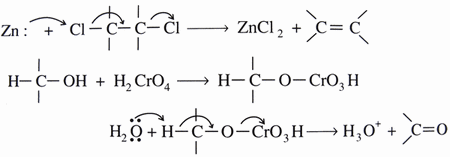 |
Exercice 1: La nitration du phénol se fait avec le réactif électrophile NO2+ (obtenu en mélangeant HNO3 et H2SO4). Prévoir sur quelle(s) position(s) du cycle benzénique se substitueront de préférence les groupes nitro.