 Electrochimie -
Types de piles
Electrochimie -
Types de piles
Logiciels et bibliographie
Programme d'étude
Cours
Electrochimie
- Oxydation
- Nombre d'oxydation
- Réaction redox
- Equilibrage*
- Applications
- Potentiel redox
- Prévision de réaction*
- Corrosion
- Les piles
- Types de piles*
- Electrolyse*
- Exercices*
Pile Leclanché
C'est une pile sèche constituée par une enveloppe en Zn et un bâton de graphite qui constituent les deux électrodes. L'espace entre les deux électrodes est occupé par un mélange de MnO2, NH4Cl, ZnCl2 d'eau et de gélifiant. Ces constituants forment une solution électrolytique "gélifiée" et rendent la pile moins sensible aux chocs.
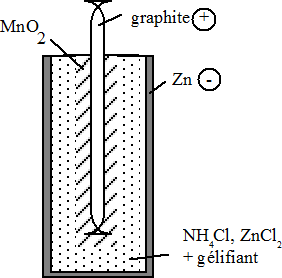 |
Les réactions aux électrodes
sont les
suivantes:
Pôle (-) : Zn  Zn2+ + 2e-
Eo =
0,76 V
Zn2+ + 2e-
Eo =
0,76 V
Pôle (+) : Potentiel standard de cette pile : ΔEo = 1,5V |
Un autre type de pile sèche important est la pile au nickel-cadmium. Dans cette pile les produits de la réaction adhèrent aux électrodes, on peut ainsi la recharger un grand nombre de fois.
Pile au mercure
Elles se prêtent à la miniaturisation tout en assurant une tension stable.
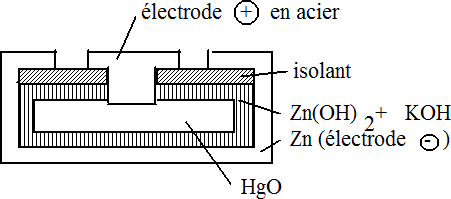 |
La réaction globale est la
suivante: Zn + HgO  ZnO + Hg ZnO + Hg0 +II -II +II -II 0 Zn/Zn2+ Eo = - 0,76 V Hg/Hg2+ Eo = 1.71 V (0,91 + 0,8) d.d.p. ΔEo = 2.47 V |
Pile à combustible
Les piles étudiées jusqu'à présent ont l'inconvénient d'avoir une durée de vie limitée. On peut cependant réaliser une pile dans laquelle le réducteur et l'oxydant sont fournis de façon continue. C'est ce que l'on appelle les piles à combustible.
La pile à combustible la plus simple qui existe est la pile "hydrogène-oxygène", pour 1g de H2 consommé, on obtient la même quantité d'électricité que si on utilisait 32,5 g de zinc. Ces piles sont hélas encore coûteuses.
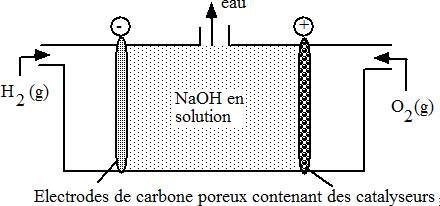 |
Les réactions aux électrodes
sont: Pôle (-) : H2(g) + 2OH-  2H2O + 2e-
Eo = 1.18 V 2H2O + 2e-
Eo = 1.18 VPôle (+) : O2 + 2H2O + 4e-  4OH- 4OH- Eo = 0,40 V |
Globalement
la réaction est : 2H2 + O2  2H2O
ΔEo = 1.58 V
2H2O
ΔEo = 1.58 V
L'eau est éliminée au fur et à mesure de sa formation. De telles piles sont utilisées dans les véhicules spatiaux, l'eau produite peut même être utilisée !
Exercices
Exercice 1: Quelle
est la différence de potentiel standard d'une pile formée des couples
a) Zn++/Zn et Cu++/Cu
b) Ni++/Ni et Zn++/Zn
Ecrire les
équations des réactions qui ont lieu à la cathode et à
l'anode.

Exercice 2: Déterminons
la f.é.m. d'une pile pour laquelle la réaction globale est:
Fe(s) + Cd2+(aq)  Cd(s) + Fe2+(aq)
Cd(s) + Fe2+(aq)

Exercice 3: Les
batteries de voiture sont constituée de PbO2(s) ׀ Pb2+(aq) ׀
׀ Pb2+/aq) ׀
Pb(s)
Déterminer sont potentiel.
