 Electrochimie -
Nombre d'oxydation
Electrochimie -
Nombre d'oxydation
Logiciels et bibliographie
Programme d'étude
Cours
Electrochimie
- Oxydation
- Nombre d'oxydation
- Réaction redox
- Equilibrage*
- Applications
- Potentiel redox
- Prévision de réaction*
- Corrosion
- Les piles
- Types de piles*
- Electrolyse*
- Exercices*
Afin de pouvoir mieux déterminer quels sont les réducteurs et les oxydants dans une réaction, on définit un nouveau concept, celui de nombre d'oxydation.
On appelle nombre d'oxydation d'un atome la charge que prendrait cet atome si, dans chacune des liaisons qu'il forme avec ses voisins, on attribuait les électrons de liaison à l'atome le plus électronégatif. Ce nombre s'écrit en chiffres romains.
Exemple : CO2
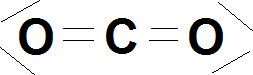 |
Atome(s) le(s) plus électronégatif(s) : O Électron(s) attribués à l'oxygène : 8 Nombre d'oxydation de l'oxygène : -2 Électron(s) attribués au carbone : 0 Nombre d'oxydation du carbone : +4 |
Une série de règles pratiques permettent de déterminer plus facilement les nombres d’oxydation.
|
Exercice 1: En ajoutant de l'eau à un mélange de poudre
d'aluminium et I2, on observe une réaction violente. Pour cette
réaction:
a) trouver les nombres d'oxydation.
b) Identifier quels sont les atomes oxydés et réduits.
c) Identifier l'oxydant et le réducteur.

Exercice 2: Trouver
les nombres d'oxydation de tous les atomes des corps
suivants:
1) CO2
2) SF6
3)
NO3–
4)
NH4+
5)
KMnO4
6) Fe3O4
7) NiO2
8)
XeO2F2 9) (NH4)2HPO4

1) ClO– 2) ClO2– 3) ClO3– 4) ClO4–
