 Electrochimie -
Corrosion
Electrochimie -
Corrosion
Logiciels et bibliographie
Programme d'étude
Cours
Electrochimie
- Oxydation
- Nombre d'oxydation
- Réaction redox
- Equilibrage*
- Applications
- Potentiel redox
- Prévision de réaction*
- Corrosion
- Les piles
- Types de piles*
- Electrolyse*
- Exercices*
Lors de la corrosion d’un métal, celui-ci cède des électrons et forme des composés très différents du métal de départ. Ce phénomène spontané a des conséquences économiques importantes. Chaque année par exemple, le 1/5 de la production mondiale de fer est destinée à remplacer le métal qui se corrode spontanément.
Corrosion et passivation
A l'exception des métaux précieux, comme l'or ou le platine, tous les métaux réagissent avec l'oxygène de l'air; tous sont donc recouverts d'une couche superficielle d'oxyde.
Deux cas se présentent:
- Si la couche est imperméable à l'oxygène, l'oxydation reste superficielle: le métal est passivé par la couche formée. C'est le cas de l'aluminium, du chrome et du titane.
- Si la couche est perméable à l'oxygène, l'oxydation peut se poursuivre: le métal est corrodable. Le fer, le métal le plus employé, se range malheureusement dans cette catégorie.
(on peut encore mentionner les cas du zinc, du plomb et du cuivre qui ne sont pas parfaitement protégés, mais qui s'oxydent très lentement)
Mécanisme de la corrosion*
La formation de rouille est un phénomène électrochimique. L'humidité doit donc être présente car elle joue un rôle similaire au pont électrolytique d’une pile électrochimique.
Tous les métaux placés en dessous de E° = – 0.83 V peuvent être oxydés par l'eau aux conditions standards:
2 H2O + 2 e-  H2 + 2 OH-
E° = - 0.83 V (pH = 14)
H2 + 2 OH-
E° = - 0.83 V (pH = 14)
2 H2O + 2 e-  H2 + 2 OH-
E = - 0.42 V (pH = 7)
H2 + 2 OH-
E = - 0.42 V (pH = 7)
Comme
Fe++
+ 2 e-  Fe
E°
= - 0.44 V , l'oxydation ne se fait presque pas! Un
clou dans de l'eau pure sans oxygène
ne rouille donc pas.
Fe
E°
= - 0.44 V , l'oxydation ne se fait presque pas! Un
clou dans de l'eau pure sans oxygène
ne rouille donc pas.
Par contre, s'il y a de l'air et de l'eau, on a aussi:
O2 + 4 H+
+ 4 e-  2
H2O
E° = 1.23 V
2
H2O
E° = 1.23 V
O2 + 4 H+
+ 4 e-  2
H2O
E° = 0.81 V (pH =7)
2
H2O
E° = 0.81 V (pH =7)
Cette fois le potentiel est beaucoup plus grand que celui du fer. Une goutte d'eau sur du fer forme une petite cellule électrochimique.
 |
Au bord de la goutte l'oxygène dissous oxyde le fer qui passe en solution sous forme de Fe2+ dans la région pauvre en oxygène, donc au centre de la goutte, formant un trou. |
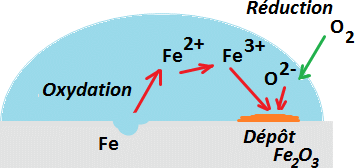 |
Les ions Fe2+ s'oxydent en Fe3+ qui précipitent sous forme de Fe2O3·H2O. |
Si l'eau est salée, l'eau est plus conductrice, le processus est donc plus rapide.
Prévention de la corrosion électrochimique
Les méthodes de prévention de la corrosion sont très importantes car cela permet de préserver nos ressources naturelles. Ces méthodes peuvent être :
- Revêtement non-métallique: émail, peinture, vernis, plastique....
- Recouvrir le métal avec une peinture (minium par exemple) ou un autre métal (chrome ou étain sur l'acier car ils forment des oxydes stables).
- Recouvrir l'acier avec du zinc (galvanisation), comme Zn est un meilleur réducteur que Fe, il se corrode avant lui.
- Faire des alliages, par exemple l'acier inoxydable contient du chrome et du nickel qui donne au mélange un potentiel voisin de ceux des métaux nobles.
- Pour protéger les canalisations on utilise souvent une protection dite « cathodique ». On relie par un fil la canalisation que l'on veut protéger à un métal très réducteur comme le magnésium. C'est Mg (plus réducteur que Fe) qui donnera alors ses électrons! Comme Mg va ainsi se dissoudre petit à petit, il faudra le remplacer périodiquement.
Exercices
Exercice 1: Que
signifie le terme "passivation"?

Exercice 2: Parmi
les métaux suivants, lesquels peuvent servir d'anode sacrifiée pour
protéger une conduite en fer: Ca, Ag, Cu, Mg? (justifier)
