 Electrochimie -
Oxydation
Electrochimie -
Oxydation
Logiciels et bibliographie
Programme d'étude
Cours
Electrochimie
- Oxydation
- Nombre d'oxydation
- Réaction redox
- Equilibrage*
- Applications
- Potentiel redox
- Prévision de réaction*
- Corrosion
- Les piles
- Types de piles*
- Electrolyse*
- Exercices*
La rouille est un oxyde de fer. On dit que le fer s'oxyde car il réagit avec le dioxygène de l’air.
Actuellement le terme oxydation est devenu plus général, l'oxygène n'intervient pas forcément dans toutes les réactions d’oxydation.
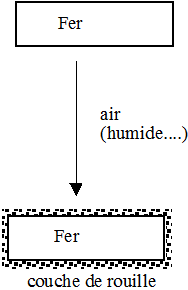 |
État initial Fer Chaque atome de fer a le même nombre d'électrons et de protons s’il n’est pas chargé. Dioxygène Idem, il est globalement non chargé.
État final Rouille Des atomes de fer et d'oxygène se sont associés pour former des "molécules". C'est également un corps composé globalement non chargé. |
Le fer donne facilement des électrons à l'oxygène qui est électronégatif. Il y a donc un transfert d'électrons entre Fe et O2. Le schéma suivant généralise la notion de réaction d’oxydo-réduction :
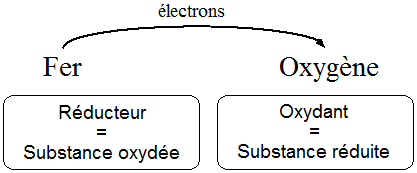 |
L’oxydation ne peut pas se faire sans la réduction, c'est pourquoi on parle de réaction d'oxydo-réduction (ou réaction redox) |
Oxydation: Prendre
un (ou des) électron(s) à une substance qui est ainsi oxydée.
Réduction: Donner
un (ou des) électron(s) à une substance qui est ainsi réduite.
Exercice 1:
Dans la réaction: 2Na (s) + Cl2
(g)  2NaCl (s)
2NaCl (s)
Dire quel est :
a)
L'oxydant. b) Le réducteur.
c) La substance oxydée. d) La
substance réduite.
