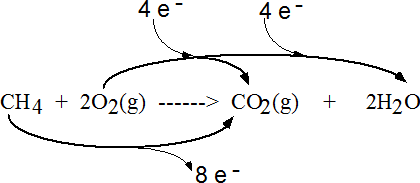Electrochimie -
Réaction redox
Electrochimie -
Réaction redox
Logiciels et bibliographie
Programme d'étude
Cours
Electrochimie
- Oxydation
- Nombre d'oxydation
- Réaction redox
- Equilibrage*
- Applications
- Potentiel redox
- Prévision de réaction*
- Corrosion
- Les piles
- Types de piles*
- Electrolyse*
- Exercices*
Parfois le transfert d'électrons aboutit à la formation d'ions :
2Na (s) + Cl2
(g)
 2
NaCl (s)
2
NaCl (s)
Mais le plus souvent le transfert d'électrons ne produit pas d’ions.
Exemple :
CH4 +
2O2(g)  CO2(g) +
2H2O
CO2(g) +
2H2O
–IV/+I
0
+IV/–II
+I/–II
Le carbone passe du n.o. (–IV) au n.o. (+IV). On peut expliquer ceci en considérant que le carbone perd 8 électrons lors de la formation de CO2.
CH4  CO2
+ 8e–
CO2
+ 8e–
(–IV)
(+IV)
De la même manière on peut dire que l'oxygène passe du n.o. (0) à (–II). On a donc 4 atomes d'oxygène qui gagnent chacun 2 électrons. Au total ce sont donc 8e– qui sont gagnés par l'oxygène.
2O2
+ 8e–
 CO2 + 2H2O
CO2 + 2H2O
On peut représenter la réaction redox ainsi:
|
|
Le système ne perd pas d'électrons. On assiste à un transfert de 8 e- entre 1 atome de C et 4 atomes de O. |
Exercice 1: L'extraction
d'un métal de son minerai repose toujours sur des réactions
d'oxydo-réduction. Ainsi, pour isoler le plomb de la galène,
PbS, on oxyde d'abord PbS selon :
2PbS (s) + 3O2 (g)
 2PbO (s) + 2SO2 (g)
2PbO (s) + 2SO2 (g)
Après quoi, on traite l'oxyde de plomb par le monoxyde de carbone (CO) pour produire du Pb pur :
PbO (s) + CO (g)
 Pb (s) + CO2 (g)
Pb (s) + CO2 (g)
Dans chacune de ces réactions :
a) Identifier quels sont les atomes oxydés et réduits.
b) Identifier quels sont le réducteur et l'oxydant.
c) Déterminer le nombre d'électron(s) transféré(s) lors de chaque
réaction.

Exercice 2: Faire comme
à l'exercice précédent pour les réactions:
 CO2
(g) + 2H2O
(g)
CO2
(g) + 2H2O
(g) b) Zn (s) + 2HCl (aq)
 ZnCl2 (aq) + H2 (g)
ZnCl2 (aq) + H2 (g) c) Cr2O72– (aq) + 2OH– (aq)
 2CrO42– (aq) + H2O
(l)
2CrO42– (aq) + H2O
(l) d) O3 (g) + NO (g)
 O2
(g) + NO2 (g)
O2
(g) + NO2 (g)