 Electrochimie -
Potentiel redox
Electrochimie -
Potentiel redox
Logiciels et bibliographie
Programme d'étude
Cours
Electrochimie
- Oxydation
- Nombre d'oxydation
- Réaction redox
- Equilibrage*
- Applications
- Potentiel redox
- Prévision de réaction*
- Corrosion
- Les piles
- Types de piles*
- Electrolyse*
- Exercices*
Le fer s'oxyde facilement (rouille)
alors que l'or ne s'altère pas.
Chaque substance a une tendance propre à prendre ou donner des
électrons. On utilise pour quantifier cette tendance le potentiel
redox. Cette grandeur est fortement liée à l'électronégativité.

Par exemple le fluor à une très forte tendance à prendre des électrons (donc être réduit):
F2 + 2 e- 2 F-
E° = 2,87 V
C'est
donc un oxydant très fort
2 F-
E° = 2,87 V
C'est
donc un oxydant très fort
Le sodium est au contraire un réducteur fort car il s'oxyde très facilement:
Na+
+ e -  Na E° =
- 2,71 V
Na E° =
- 2,71 V
Pour mesurer le potentiel redox d'un couple on utilise un potentiomètre. On doit mesurer le potentiel du couple à étudier par rapport à un autre couple de référence. Ce couple de référence est constitué d’une électrode à hydrogène et où on a la demi-réaction suivante :
2H+
+ 2e-  H2
E° = 0,00 V
H2
E° = 0,00 V
Le potentiel d'un couple dépend de la concentration du réducteur et de l’oxydant, de la pression et de la température. On définit Eo comme étant le potentiel normal aux conditions standards de 1 atm, 25°C et pour des concentrations de l’oxydant et du réducteur de 1mol/L.
Par conventions, on écrit les équations des couples redox comme des réductions.
On peut ainsi classer les pouvoirs oxydant et réducteur, on appelle ceci la série électrochimique.
Cette table de potentiel permet de prévoir ce qui va se passer en cas de contact entre deux substances ainsi que que la différence de potentiel mise en jeux.
N.B.* Pour trouver les valeurs de potentiels dans d'autres conditions, on utilise l'équation de Nernst:
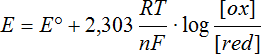 |
E° :
potentiel standard R : 8.314 J/K·mol F : 96'500 C/mol n: nombre d'électrons transférés pour le couple redox [ox] : concentration molaire de la forme oxydée [red] : concentration molaire de la forme réduite Par convention on prend comme concentration la valeur 1 pour les substances présentes sous forme élémentaire. |