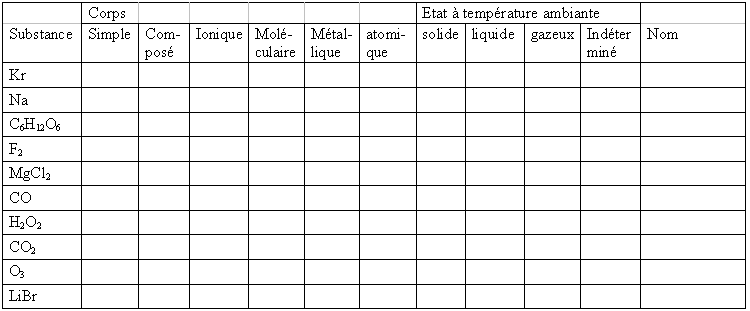
La matière:
Types de corps
La matière:
Types de corps
Logiciels et bibliographie
Programme d'étude
Cours
La matière
- Température
- Etats de la matières
- Types de corps
- Nomenclature*
- Mélanges
- Solutions
- Analyse immédiate
- Exercices
Il est important de clarifier ce que l'on entend par "corps", en effet, quand on parle de corps simple, corps pur ou corps ionique, on ne fait pas du tout appel au même concept.
Corps simples et corps composés
Ces termes se rapportent à la composition de la substance:
corps simple: La substance est constituée
d'atomes
appartenant tous au même élément.
Exemples: eau H2O, chlorure de calcium CaCl2
Corps purs
Ce terme se rapporte à une situation expérimentale.
Pratiquement il est impossible de préparer une substance formée uniquement de molécules ou atomes identiques. Elles contiennent toujours des impuretés en plus ou moins grande quantité.
S'il y a peu d'impuretés on dit par abus de langage qu'on a affaire à un corps pur.
On distingue souvent trois qualités:
- Technique: Sort du procédé de séparation.
- Pur: Qualité ordinaire du laboratoire.
- Très pur: Etalonnage des appareils, recherche. Cette qualité est souvent aussi appelée "pour analyse" (p.a.).
Corps covalents, ioniques, métalliques et atomiques
Ces termes se rapportent aux types de liaisons qui interviennent au niveau intime de la matière.
Corps covalents
Aussi appelé corps moléculaires, ce sont des substances ne contenant pas de métaux. Elles ont des propriétés variables. Il est à noter que parfois ces substances par chauffage ne deviennent pas une gaz mais se décomposent.
Exemples:
|
|
Corps ioniques
Les composés ioniques sont souvent solubles dans les solvants polaires comme l’eau. Les dipôles entourent alors chaque ion, il y a dissociation de l’édifice cristallin.
Les composés ioniques sont généralement insolubles dans les solvants non polaires comme le pétrole par exemple.
Les solides ioniques sont généralement durs cassants car les ions ne peuvent pas glisser les uns sur les autres à cause de leur répulsion électrostatique.
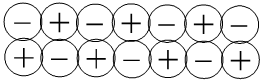 |
Les deux couches adhèrent fortement. Si une force extérieure provoque un glissement, alors il y a répulsion entre les deux couches. |
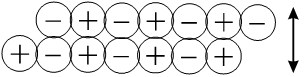 |
Il se produit alors une séparation brutale des deux couches (clivage) du cristal. |
Exemple: NaCl chlorure de sodium ou sel de cuisine
Corps métalliques
ils sont formés de métaux, ils conduisent la chaleur et l'électricité et sont malléables.
On y ajoute parfois des non métaux en petite quantité pour les rigidifier, ainsi en ajoutant du carbone au fer, on obtient l'acier puis la fonte.
On
les mélange aussi souvent entre eux pour obtenir des alliages qui ont
des propriétés intéressantes, par exemple:
- Laiton, jusqu’à 40% de zinc dans du cuivre.
- Bronze, un métal autre que le zinc dans du cuivre.
- Acier inoxydable, à partir de 12% de chrome dans du fer.
Corps atomiques
Ce sont typiquement les gaz rares. Ils sont parfois considérés comme des corps covalents car à l'état solide, c'est à dire à très basse température, la cohésions est assurée par des forces de Van der Waals.
Exercices
Exercice 1: Un corps
moléculaire peut-il être un corps simple?

Exercice 2: Un corps
ionique peut-il être un corps simple?

Exercice 3:
Compléter