 La matière:
Solutions
La matière:
Solutions
Logiciels et bibliographie
Programme d'étude
Cours
La matière
- Température
- Etats de la matières
- Types de corps
- Nomenclature*
- Mélanges
- Solutions
- Analyse immédiate
- Exercices
Une solution est un mélange homogène d'une substance en petite quantité appelée soluté dissoute dans une autre en grande quantité appelée solvant.
Exemple: L'eau salée (le sel est le soluté et l'eau le solvant).
Le solvant le plus courant est l'eau mais pour certains usages on utilise des solvants organiques comme l'alcool, la benzine etc…
Dans un solvant le soluté peut subir:
|
 |
|
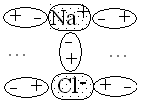 |
Solution non-électrolyte (dissolution)
Les molécules se séparent s'il y a une affinité importante entre la molécule et le solvant. La substance est donc soluble dans ce cas.
- Les
molécules polaires ou ayant des ponts hydrogènes sont plus facilement
solubilisée dans un sovant polaire comme l'eau. Le sucre par exemple
est soluble dans l'eau car la molécule n'est pas trop grosse et
contient beaucoup de ponts hydrogènes.
- Les molécules non polaires, comme les graisses par exemple ne sont pas solubles dans les solvants polaire comme l'eau mais le sont dans des solvants non polaires comme l'essence par exemple.
Solution électrolyte (dissociation)
Il y a dissociation
si la substance est
ionique et que son affinité pour le solvant est plus grande que son
affinité pour elle-même. Tableau
de solubilité des sels dans l'eau: 
Il peut aussi y avoir dissociation dans l'eau pour des molécules ayant des hydrogènes pas très fortement lié à la molécule car les H+ ou proton ont une grande affinité avec l'eau.
On a ainsi plusieurs catégories d'électrolytes:
- Les
acides
Molécules qui contiennent un ou plusieurs atome(s) d'hydrogène détachable(s) en solution sous la forme de H+ (H+ = proton).
Exemple: HCl est une molécule polaire (différence d'électronégativité de 0,9) dissociée dans l'eau.
HCl + H2O H3O+ + Cl-
H3O+ + Cl-
H+ est capté par l'eau, on appelle ce transfert une protolyse .
- Les
hydroxydes
Substances contenant l'anion hydroxyde OH -.
Exemple: NaOH Na+ + OH-
Na+ + OH-
- Les sels
Substances formées d'un cation et d'un anion autres que H3O+ et OH - .
Exemple: NaCl Na+
+ Cl-
Na+
+ Cl-
Force des électrolytes
Ce terme est utilisé pour déterminer le degré de dissociation en ions.
Exemples
- HCl est un électrolyte
fort:
HCl + H2O H3O+ + Cl-
H3O+ + Cl-
100 % dissocié
- CH3COOH
est un électrolyte faible:
CH3COOH + H2O CH3COO- + H3O+
CH3COO- + H3O+
99.35 % 0.65%