 La matière:
Etats de la matière
La matière:
Etats de la matière
Logiciels et bibliographie
Programme d'étude
Cours
La matière
- Température
- Etats de la matières
- Types de corps
- Nomenclature*
- Mélanges
- Solutions
- Analyse immédiate
- Exercices
On distingue 3 états pour la matière, les passages d'un état à l'autre portent des noms spécifiques.
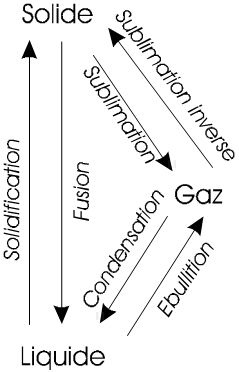 |
Solide:
Liquide:
Gaz:
|
Structure cristalline des solides
Les solides, vu les grandes forces de cohésion, s'arrangent généralement régulièrement pour former un cristal.
Exemples: Quartz, diamant......
Il arrive que certains solides ne soient pas cristallins. On dit alors qu'on a un solide amorphe (ils ont souvent tendance à cristalliser petit à petit)
Exemples:
Verre, plastique,
charbon ..... 
Certains solides peuvent exister sous plusieurs formes cristallines différentes. On appelle ce phénomène allotropie
Exemple: Le carbone peut s'arranger en diamant ou graphite (en plus du carbone amorphe ou charbon)
Dureté des solides
Pour
quantifier la dureté des solides, Mohs a établit une échelle. Celle-ci
est basée sur la comparaison des solides entre eux. Celui qui arrive à
rayer un autre est dit plus dur. Cette échelle va de 1 à 10, l'ongle a
une dureté de 2.2 et le diamant une dureté de 10. 