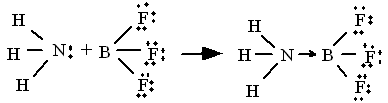Liaison
chimique: La règle de l'octet
Liaison
chimique: La règle de l'octet
Logiciels et bibliographie
Programme d'étude
Cours
Liaison chimique
- Règle de l'octet
- Liaison ionique
- Liaison covalente
- Liaison métallique
- Formule chimique
- Formule développée
- Forme et polarité des molécules
- Le modèle RPEV*
- Forces intermoléculaires
- Résumé
On a observé que la dernière colonne du tableau périodique, appelée aussi colonne des gaz rares ou inertes, est composée d'éléments particulièrement stables et inertes chimiquement. Ceci est à l'rigine de la règle:
Lors de la formation de liaisons chimiques, les atomes cherchent à acquérir la structure électronique du gaz rare le plus proche.
Pour les éléments C, N et O qui sont les plus abondant dans les molécules du vivant (avec H), cela signifie 8 électrons (un octet) sur la dernière couche. Ceci est à l'origine du nom de cette règle: la règle de l'octet.
Exercice 1:
Ecrire les ions stables des éléments S, Mg, K, Al,
O, I 
Exceptions à la règle de l'octet
La règle de l'octet est simple mais elle souffre de nombreuses exceptions.
Le Bore notamment a tendance à former des composés avec moins de 8 électrons. Par exemple BF3 est un gaz qui réagit violemment avec des composés ayant une paire d'électrons libres (appelés bases de Lewis). La structure développée qui représente le mieux ses propriétés est représentée ci-dessous :
| On remarque ici que le bore est entouré de six électrons. | 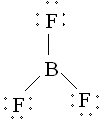 |
| On pourrait essayer de le
représenter
avec 8 électrons comme suit : Comme le fluor est beaucoup plus électronégatif que le bore cette solution est peu vraisemblable. |
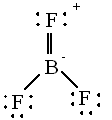 |
La deuxième écriture est d'autant plus peu valable qu'elle ne rend pas compte de la réactivité du BF3 avec l'ammoniac: