 Liaison
chimique: Forme et polarité des molécules
Liaison
chimique: Forme et polarité des molécules
Logiciels et bibliographie
Programme d'étude
Cours
Liaison chimique
- Règle de l'octet
- Liaison ionique
- Liaison covalente
- Liaison métallique
- Formule chimique
- Formule développée
- Forme et polarité des molécules
- Le modèle RPEV*
- Forces intermoléculaires
- Résumé
Une molécule ayant des liaisons polarisées peut être polaire ou non suivant sa forme.
Forme des molécules
La
forme d'une molécule influence beaucoup sa
réactivité. 
En
connaissant la structure de Lewis,
on peut prédire la forme des molécules. Pour ceci on regarde combien il
y a de liaisons et de doublets autour de l'atome central.
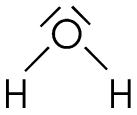 |
Pour la
molécule d'eau, l'atome central a deux
doublets d'électrons libres qui occupent autant de place
qu'une liaison et deux liaisons, cela donne 4 nuages électroniques qui
partent vers les sommets d'un tétraèdre. La molécule d'eau est donc angulaire |
 |
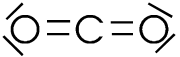 |
La molécule CO2 par contre a une forme linéaire car il n'y a que deux "nuages" d'électrons autour du carbone. | O - C - O |
2 "nuages
électroniques"  molécule linéaire (CO)
molécule linéaire (CO)
3 "nuages
électroniques"  molécule avec 3 angles de 120° si 3 atomes partent de l'atome
central.
molécule avec 3 angles de 120° si 3 atomes partent de l'atome
central.
 molécule coudée à
120° si 2 atomes partent de l'atome central.
molécule coudée à
120° si 2 atomes partent de l'atome central.
4 "nuages
électroniques"  molécule avec 4 angles de 109° si 4 atomes partent de l'atome
central.
molécule avec 4 angles de 109° si 4 atomes partent de l'atome
central.
 molécule avec 3
angles de 109° si 3 atomes partent de l'atome central.
molécule avec 3
angles de 109° si 3 atomes partent de l'atome central.
 molécule coudée à
109° si 2 atomes partent de l'atome central. (H2O)
molécule coudée à
109° si 2 atomes partent de l'atome central. (H2O)
"Nuages":
 3
possibilités avec 4 "nuages":
3
possibilités avec 4 "nuages": 
Polarité des molécules
On dessine la molécule en tenant compte de sa forme, on attribue ensuite les défauts et excès d'électrons et on regarde s'il y a une dissymétrie des charges:
 |

 |
|
Pour le CO2 les polarités des liaisons opposées s'annulent car la molécule est linéaire. |
Pour H2O, les polarités ne s'annulent pas et la molécule d'eau est polaire car cette molécule n'est pas linéaire. |
| La molécule n'est pas polaire | La molécule est polaire |
Les molécules polaires sont sensibles à l'action d'un champ électrostatique.
Comme l'eau est polaire, elle peut dissocier des cristaux ioniques comme NaCl. Lors de leurs dissolutions à l'état liquide, les Na+ sont entourés par la partie d- des molécules d'eau et inversement pour les Cl-. Les charges ainsi mises en solution permettent à l'eau salée de conduire l'électricité.
Exercices
Exercice 1:
Dessiner les formules développées de Lewis des
molécules et ions suivants et déduire leur structure et
leur polarité.
a) H2O
; NH3
; HF ; HCN; 
b) CH4
; OF2
; NH4+
; PBr3
; H3O+;
H2SO4
c) CS2
; SO2 ;
CHCl3
; NH2–
; C2H4
;
d) PCl5
; TeCl4
; ClF3
; IF5
;
Exercice 2: La
molécule XO3
n'est pas polaire. A quelle colonne appartient X? Expliquer.

Exercice 3: Expliquer
pourquoi un jet d'eau est
attiré par un bâton d'ébonite chargé
négativement. Donner un exemple de substance qui ne serait pas
attirée. 