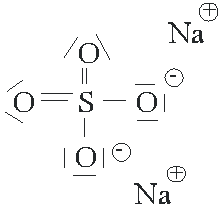Liaison
chimique: Formule développée
Liaison
chimique: Formule développée
Logiciels et bibliographie
Programme d'étude
Cours
Liaison chimique
- Règle de l'octet
- Liaison ionique
- Liaison covalente
- Liaison métallique
- Formule chimique
- Formule développée
- Forme et polarité des molécules
- Le modèle RPEV*
- Forces intermoléculaires
- Résumé
Pour dessiner une formule développée selon Lewis:
- Identifier les types de liaisons qui interviennent (covalent, ionique).
- Faire la somme des électrons de valence des atomes de la molécule à représenter.
- Dessiner le "squelette" de la molécule telle
qu’on peut l'imaginer avec une liaison simple entre chaque atome
lié.
- Si il y a un atome "central" c'est généralement le plus gros.
- H se lie de préférence à O.
- les atomes ne se lient pas avec eux-mêmes s’ils ont le choix, sauf le carbone (et parfois S et P). - Compléter l'octet de chaque atome lié à l'atome central (H n'a besoin que de deux électrons).
- Placer ensuite tous les électrons restants sur l'atome central même si l'octet est dépassé.
- S'il n'y a pas assez d'électrons pour donner 8 électrons à l'atome central, utiliser les liaisons multiples.
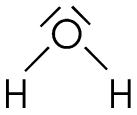
Exemples:
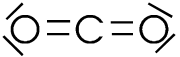 |
 |
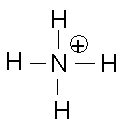 |
| CO2 | H2O | NH4+ |
Si un groupe d'atomes porte une charge négative, c'est
qu'il a donné ou reçu un ou plusieurs électrons.
Exemple
OH -:
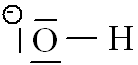 |
l'électron supplémentaire est attribué à l'atome qui le désire le plus, c'est-à-dire à l'atome le plus électronégatif. |
Dans le cas d'un ion positif, on enlève un électron à l'atome le moins électronégatif.
Exercice
1: Dessiner les formules développées selon Lewis
de :
Cl2O
SO2
HNO3
C2H2
(acétylène) C6H6
(Benzène)
ClF3
RnCl2
ClO3-
ICl4-

Ions polyatomiques
Si le composé contient un ion polyatomique, on a en présence des liaisons ioniques et des liaisons covalentes. On établit la charge de l'ion polyatomique à partir de la charge du métal et on représente la structure avec des ions.
|
|
Exemple: Na2SO4 On a ici deux cations sodium Na+ et un anion polyatomique SO4-- |
Exercice 2: Dessiner
les formules développées de Lewis des
substances suivantes:
a) H2SO4
; HBr ; PCl3
; HNO2
; Na2S ;
b) HClO4
; Na2SO3
; HIO3
; LiH ; H2SiO3
;
c) H3PO4
; CaCO3
; Ba(OH)2
; NaClO2;

Exercice 3: Dessiner
les formules développées de Lewis des
ions polyatomiques suivants et déterminer leurs
charges:
NO3x–
; ClO4x–
; HSO3x–
; NF4x+ 
Exercice 4: Dessiner
les formules développées de Lewis des
ions polyatomiques suivants:
HCO3–
; IO4–
; HPO42–
; ClO– ; NO2–;

Exercice 5: Donner
les formules des composés ioniques formés des
métaux et des ions complexes suivants:
Ba
et
NO3–
Al
et
CrO42–
Li
et
Cr2O72–
Al
et
OH–
K
et
SO32–