 Liaison
chimique: La liaison covalente
Liaison
chimique: La liaison covalente
Logiciels et bibliographie
Programme d'étude
Cours
Liaison chimique
- Règle de l'octet
- Liaison ionique
- Liaison covalente
- Liaison métallique
- Formule chimique
- Formule développée
- Forme et polarité des molécules
- Le modèle RPEV*
- Forces intermoléculaires
- Résumé
Ce type de liaison apparaît entre des atomes ayant une différence d'électronégativité faible ou nulle.
On complète l'octet de chaque atome en mettant en commun des électrons. Chaque liaison est constituée d'une ou plusieurs paires d'électrons, occupant une orbitale de liaison ou orbitale moléculaire (une partie du nuage électronique est commune aux deux atomes liés).
Ici chaque atome est lié spécifiquement à un autre, il y a formation d'une molécule.
De manière générale, ce sont les non-métaux qui se lient entre eux par des liaisons covalentes.
On distingue 2 situations:
Covalence pure (ou parfaite)
On appelle ainsi une covalence liant deux atomes de même électronégativité.
 |
Un exemple est la molécule Cl2, les deux atomes de Cl partagent une paire d'électrons pour satisfaire la règle de l'octet. Chaque atome de chlore a une valence de 7 électrons mais 8 électrons autour d'eux après la mise en commun. |
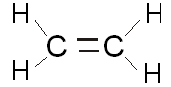  |
La liaison covalente peut donc être simple, double ou triple pour satisfaire la règle de l'octet. S'il y a deux paires d'électrons partagés, on parle de double liaison. S'il y a trois paires d'électrons partagés, on parle de triple liaison. |
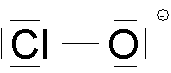 |
Pour ce ion moléculaire ClO-, la règle de l'octet est respectée mais la valence de l'oxygène est de 7 alors qu'il a normalement 6 électrons, on indique alors une charge (celle-ci ne fait pas partie de la notation de Lewis) |
Exercice 1: Dans
le tableau suivant on a l'énergie de liaison
(énergie requise pour séparer la molécule en
atomes) et les longueurs de liaison:
Molécule
Energie de liaison
(kJ/mole)
Longueur de liaison (nm)
O2
498
0,121
N2
945
0,110
Cl2 243
0,199
Dessiner les formules selon Lewis de ces molécules.
Y
a-t-il une corrélation entre le nombre de liaisons entre les
deux atomes et l'énergie de liaison ainsi que la longueur
de liaison? 
Covalence polarisée
La liaison covalente entre deux éléments différents entraîne une dissymétrie de charge car l'électronégativité est différente.
La liaison est dite polarisée (un dipôle électrique),
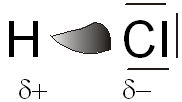 |
Par exemple pour HCl, l'EN du chlore est de 3.1 et celle de l'hydrogène de 2.2, cette différence de 0.9 fait que les électrons sont déplacés du coté du chlore qui se trouve ainsi avec un léger excès d'électron. |
Plus la différence d'électronégativité est grande, plus forte est la polarisation de la liaison. Il y a un passage progressif de la covalence pure à la liaison ionique (il n'y a d'ailleurs pas de liaison ionique à 100%).
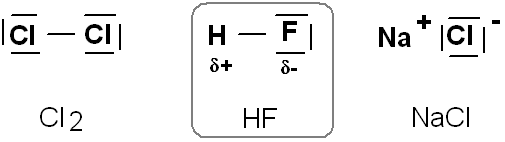
On admettra que la liaison est covalente tant qu'on peut discerner des molécules.
Exercice 2: Pour
HF, HCl, HBr, HI, déterminer la différence d'électronégativité et dire
laquelle de ces liaisons est la plus polarisée. 