 Liaison
chimique: Le modèle RPEV
Liaison
chimique: Le modèle RPEV
Logiciels et bibliographie
Programme d'étude
Cours
Liaison chimique
- Règle de l'octet
- Liaison ionique
- Liaison covalente
- Liaison métallique
- Formule chimique
- Formule développée
- Forme et polarité des molécules
- Le modèle RPEV*
- Forces intermoléculaires
- Résumé
On peut prévoir la forme des molécules simples de type ABn en sachant que:
|
C'est le modèle RPEV (répulsion des paires d'électrons de valence) |
Par convention appelons :
A : L'atome central.
B :
Les
atomes liés à l'atome central.
E :
Les paires
d'électrons non liantes de l'atome central.
Pour l'eau la notation est alors AB2E2 et pour le gaz carbonique AB2
La somme des "B" et "E" donne la forme dans laquelle la molécule est inscrite:
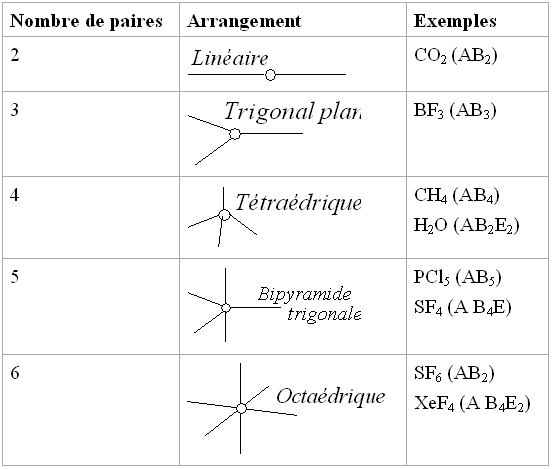
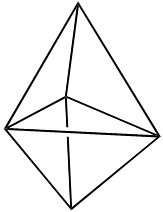
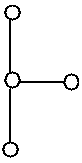
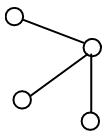
Dans certains cas, plusieurs formes pour une même molécules sont possibles, une molécule de type AB3E2 par exemple peut donner trois formes différentes:
 |
 |
 |
 |
| Inclu dans une bipyramide trigonale (BPT) | Forme "T" | Tétraèdre déformé | Trigonale plane |
Possibilités avec 5 et 6 nuages

Application avec XeF4

Formes dans l'ADN 
Exercice
1: Prévoir la forme et la polarité d'une molécule de NH3.

Exercice 2:
Dessiner
les formules développées selon Lewis, la notation
rpev, la forme dans l’espace et
la polarité des
molécules suivantes:
CS2,
CH4,
ClF3,
ClF5,
PCl5,
H2O,
SnCl2,
XeF2,
XeF4,BCl3,
CO2,
SF4,
SF6,
PCl3

Exercice 3:
Combien
de formes de molécules sont possibles pour une molécules de type AB4E2,
faire des dessins. 
Exercice 4:
Dessiner
les formules développées selon Lewis des
molécules et ions suivants et en déduire leur structure
dans l’espace et leur polarité.
a) H2O ; NH3
; SO32– ; HF ; HCN
b) CH4 ; OF2
; NH4+ ; PBr3
; H3O+;
H2SO4
c) CS2 ; SO2
;
CHCl3 ; NH2–
d) PCl5
; TeCl4 ; ClF3 ; IF5
; 