 Liaison
chimique: La liaison ionique
Liaison
chimique: La liaison ionique
Logiciels et bibliographie
Programme d'étude
Cours
Liaison chimique
- Règle de l'octet
- Liaison ionique
- Liaison covalente
- Liaison métallique
- Formule chimique
- Formule développée
- Forme et polarité des molécules
- Le modèle RPEV*
- Forces intermoléculaires
- Résumé
Ce type de liaison s'établit lorsque la différence d'électronégativité est grande entre les atomes. On considère alors qu'il y a transfert d'électron d'un atome vers l'autre.
En pratique, elle apparaît essentiellement entre métaux et non-métaux, ce qui correspond généralement à une différence d'électronégativité supérieur à 1,7.
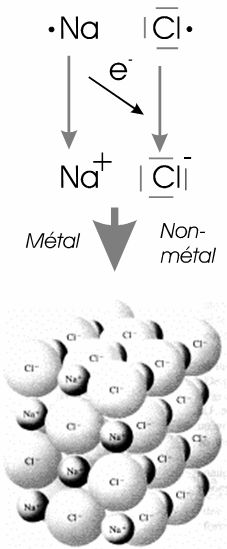 |
Un exemple type est le sel de cuisine NaCl: Les atomes Na et Cl échangent un électron pour atteindre, tous deux, la structure du gaz rare le plus proche. Les ions Na+ et Cl- ainsi formés s'attirent mutuellement. Il n'y a pas vraiment de molécule de NaCl mais autour des Na+ se trouvent des Cl- et inversement. A l'état solide cela donne une structure bien définie appelée cristal. La combinaison ionique se réalise de manière à obtenir la neutralité électrique du cristal. Ici la différence d'électronégativité entre les deux ions est de 2.2, le caractère ionique de la liaison est donc important. |
Exercice 1:
Proposer une formule pour un composé de:
- Na et F - K et O
- Ca et Cl
- Al et O

Les composés ioniques sont des solides et ont généralement un point de fusion élevé car les attractions entre ions sont très fortes.
Pour évaluer les forces d'attraction, il faut considérer deux critères, le caractère ionique, c'est à dire la différence d'électronégativité entre les deux ions et la charge des ions:
- Plus le caractère ionique est important, plus le
point de
fusion est élevé.
Exemples : LiF fond à 842°C et LiCl à 614°C
MgCl2 fond à 708°C et CaCl2 à 782°C
- Plus la charge des ions est importante plus le point
de fusion de
ces substances est élevé.
Exemple : NaCl fond à 801°C et MgO à 2800°C
Exercice 2:
Expliquer la différence entre les points
d'ébullition des substances suivantes:
LiF: 1717oC Li2O: 2563 oC
MgO: 3260oC
