 Equilibre
chimique - définition
Equilibre
chimique - définition
Logiciels et bibliographie
Programme d'étude
Cours
Equilibre chimique
- Définition
- Déplacement de l'équilibre
- Application: changements d'états
- Application: osmose
- Application: le phare halogène
- Raisons de l'existence d'un équilibre*
- Constante d'équilibre*
- Equilibre hétérogène, produit de solubilité*
- Exercices*


Prenons par exemple la réaction :
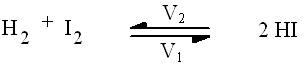
Cette réaction est réversible, c'est à dire que HI peut reformer H2 et I2.
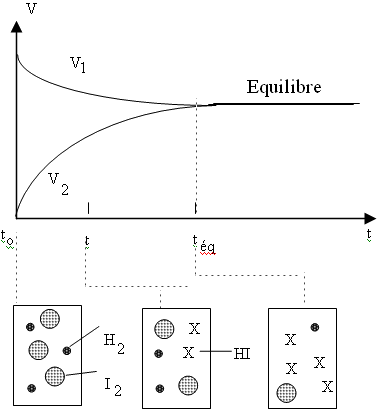 |
Au début il n'y a que H2 et I2, V1 sera donc beaucoup plus grand que V2 À mesure que HI se forme, V2 augmentera et V1 diminuera. À un certain moment on aura V1 = V2 À partir de ce moment les concentrations de H2, I2 et HI ne vont plus varier, on dit que l'on a atteint l'équilibre (dynamique). ATTENTION: Que les vitesses soient égales ne signifie pas que les quantités de réactifs et de produits sont identiques!!!! Par exemple à l'équilibre il peut y avoir très peu de réactifs et beaucoup de produits, on dit alors que l'équilibre est déplacé en faveur des produits. |