 Equilibre
chimique - constante d'équilibre
Equilibre
chimique - constante d'équilibre
Logiciels et bibliographie
Programme d'étude
Cours
Equilibre chimique
- Définition
- Déplacement de l'équilibre
- Application: changements d'états
- Application: osmose
- Application: le phare halogène
- Raisons de l'existence d'un équilibre*
- Constante d'équilibre*
- Equilibre hétérogène, produit de solubilité*
- Exercices*
Reprenons la réaction précédente :
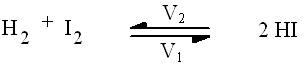
On a constaté en faisant de nombreuses expériences que :
V1 = k1 [H2] [I2] et V2 = k2 [HI]2 k1 et k2 étant les constantes de vitesse.
À l'équilibre on a V1 = V2
donc :
| k1 · [H2] · [I2] = k2 · [HI]2 d'où l'on tire : | 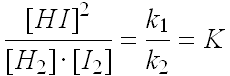 |
Cela signifie que lorsque l'état d'équilibre est atteint il y a un rapport constant entre [HI]2 et [H2] [I2] . Cette constante K est la constante d'équilibre pour cette réaction, valable à une température donnée.
On peut généraliser ce résultat à toute réaction réversible :
aA +
bB  cC + dD
cC + dD
|
et on a |
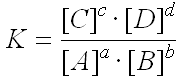 |
a, b, c, d sont les coefficients stoechiométriques |
C'est la loi d'action de masse ou loi de Guldberg et Waage.
La constante d'équilibre K peut prendre des valeurs très diverses. Ces valeurs permettent de prédire dans quel sens sera déplacé l'équilibre.
Exemples :
-
NaCl
 Na+ + Cl-
K = 1010
à 25°C
Na+ + Cl-
K = 1010
à 25°C
Cela signifie qu'il n'y a pratiquement pas de NaCl non dissocié. La réaction est complètement déplacée vers la droite. -
2H2O
 2 H2 + O2
K = 10-10 à
1727°C
2 H2 + O2
K = 10-10 à
1727°C
La réaction est ici complètement déplacée vers la gauche. -
H2 + I2
 2 HI
K = 45,9 à 490
°C
2 HI
K = 45,9 à 490
°C
Ici toutes les molécules existent car on ne peut pas négliger le numérateur ou le dénominateur.
Exercice 1
: Donner
l’expression de la constante d’équilibre pour les réactions suivantes.
a) N2 (g) + 3 H2
(g)
 2 NH3
(g)
2 NH3
(g)
b) CO (g) + NO 2 (g)  CO2 (g) + NO (g)
CO2 (g) + NO (g)
c) 4 NH3 (g) + 5 O2
(g)  4 NO (g) + 6 H2
O (g)
4 NO (g) + 6 H2
O (g)
d) 2 O3
(g)
 3
O2 (g)
3
O2 (g)
e) A (g)
+ 2 B (g)
+ 3 C (g)  4 D (g)
4 D (g)

Exercice 2
: CH3COOH  CH3COO- + H+
K = 1,8 ·
10-5 (25°C)
CH3COO- + H+
K = 1,8 ·
10-5 (25°C)
a) Déterminer la
concentration de chaque
ion en sachant que
la concentration de CH3COOH
est de 2M à l'équilibre.
b) On a mis 20 grammes d'acide acétique
dans un récipient et on a complété à un litre avec de l'eau.
Déterminer la concentration de chaque espèce. 