 Equilibre
chimique - Application: changements d'états
Equilibre
chimique - Application: changements d'états
Logiciels et bibliographie
Programme d'étude
Cours
Equilibre chimique
- Définition
- Déplacement de l'équilibre
- Application: changements d'états
- Application: osmose
- Application: le phare halogène
- Raisons de l'existence d'un équilibre*
- Constante d'équilibre*
- Equilibre hétérogène, produit de solubilité*
- Exercices*
On sait que quand une matière change d'état, la température du système reste fixe jusqu'à ce qu'une des deux phases ait disparu.
On sait aussi que l'adjonction d'un soluté modifie la température du changement d'état.
Les différents systèmes considérés ci-dessous illustrent la notion d'équilibre.
Eau et glace
Un mélange d'eau et de glace a une température de 0°C. On peut dire qu'il y a un équilibre entre la glace qui fond et l'eau qui se solidifie (situation dynamique).
Rappelons que le passage eau  glace
dégage de l'énergie (ΔH négatif)
glace
dégage de l'énergie (ΔH négatif)
Si on apporte de l'énergie au système, cela va favoriser le sens qui absobe de l'énergie, donc la fonte de la glace L'énergie ne sera donc pas utilisée pour élever la température du système!
On peut faire le même raisonnement avec un verre rempli de glace fondante, si on le met dans un congélateur il ne commencera à se refroidir que quand le sens exothermique, donc formation de glace ne pourra plus se faire, donc quand il n'y aura plus d'eau.
Eau salée et glace
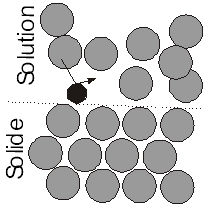 |
En ajoutant des ions dans l'eau, les molécules d'eau n'atteignent plus aussi facilement le solide. La vitesse de formation de la glace va donc diminuer. La vitesse de fonte n'est par contre pas modifiée. |
Du point de vue thermique, nos avons le sens de la fonte donc le sens endothermique qui domine, le système va donc se refroidir jusqu'à une nouvelle situation d'équilibre qui sera trouvée à une température inférieure.
Le sel sur les routes a donc deux effets, la fonte de la glace et son refroidissement.
On peut aussi dire que l'adjonction d'un soluté dans l'eau abaisse son point de fusion. L'eau de mer gèle par exemple à environ - 1.5 °C.
Point d'ébullition avec et sans soluté
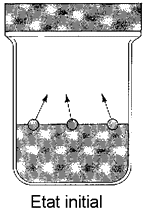 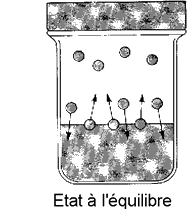 |
Un liquide (un solide aussi) est toujours en équilibre avec sa vapeur. C'est pourquoi si l’air d’une pièce est très sec, une solution aqueuse va s'évaporer petit à petit tant que la pression de vapeur de H2O dans la pièce est moins importante que celle de la solution. |
Le point d'ébullition d'un liquide est le moment où sa pression de vapeur est égale à la pression atmosphérique. En baissant la pression on abaisse donc le point d'ébullition.
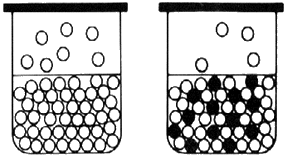 |
Quand on dissout un soluté non volatil dans un solvant, cela diminue son évaporation donc diminue la pression de vapeur du liquide. Si on abaisse sa pression de vapeur avec un soluté, il faudra donc davantage chauffer la solution pour que sa pression de vapeur atteigne la pression atmosphérique. Cette augmentation est généralement très petite et de peu d'importance pratique (une solution aqueuse de sucre 0.1 mol/L bout à ~ 100.05°C) |
Exercice 1
: Deux verres sont à moitié remplis, l'un avec de l'eau pure
et
l'autre avec de l'eau salée. On les place dans une enceinte
hermétique pour isoler le système, on attend plusieurs jours et on
observe que l'un des verres se vide et l'autre se remplis. Lequel se
vide et pourquoi?
