 Equilibre
chimique - Application: osmose
Equilibre
chimique - Application: osmose
Logiciels et bibliographie
Programme d'étude
Cours
Equilibre chimique
- Définition
- Déplacement de l'équilibre
- Application: changements d'états
- Application: osmose
- Application: le phare halogène
- Raisons de l'existence d'un équilibre*
- Constante d'équilibre*
- Equilibre hétérogène, produit de solubilité*
- Exercices*
Si on sépare deux liquides avec une membrane semi-perméable qui ne laisse passer que les molécules du solvant et non celle du soluté, il se passe un phénomène appelé osmose.
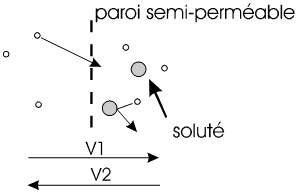 |
Au début V1 > V2 Il y a donc un transfert du solvant pur vers la solution. |
Pour que V1 = V2, il faut que la concentration en soluté soit égale des deux côtés ou que le liquide d'un côté se trouve à une pression supérieure. Ce "supplément de pression" nécessaire est appelé pression osmotique, on peut facilement la mesurer avec un tube en "U" et une paroi semi-perméable, comme ci-dessous:
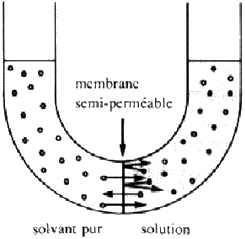
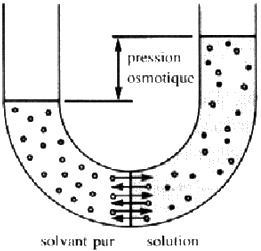
La vitesse de transfert du solvant est plus grande vers la solution que vers le solvant. Au bout d'un certain temps on atteint l'équilibre, les deux vitesses de transfert sont identiques car la pression dans la solution est supérieure.
Exemple: La saumure utilisée pour faire mariner les concombres les fait se recroqueviller.
Illustration: Préparation de chanterelles au
vinaigre: 