 Thermochimie -
enthalpie
Thermochimie -
enthalpie
Logiciels et bibliographie
Programme d'étude
Cours
Thermochimie
Pour suivre les variations d'énergie au cours des réactions chimiques, on utilise une grandeur appelée enthalpie H. On peut se représenter l'enthalpie comme la mesure de l'énergie d'un système. Quand le système perd de l'énergie (réaction exothermique), l'enthalpie diminue et inversement.
L'enthalpie est une fonction d'état, cela signifie que sa valeur dépend du système actuel et non de la façon dont il a été obtenu (comme l'altitude par exemple).
La quantité de chaleur ou énergie thermique mise en jeu se mesure en Joule et éventuellement en calorie: 1cal = 4.185 Joules. La calorie est une unité "historique", elle représente la quantité de chaleur nécessaire pour chauffer 1 g d'eau de 14,5° - 15,5 °C.
Illustration
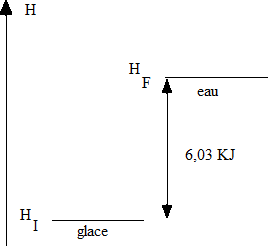 H final = H initial + énergie nécessaire pour libèrer les molécules d'eau de leurs forces de cohésion (6,03 kJ) |
Pour obtenir de
l'eau à partir de ΔHfus = H (l) - H (s) = 6.03 kJ · mol-1 Qui signifieque pour
fondre une mole de glace à Donc
l'enthalpie d'une mole d’'eau à |
Etat standard:
Etat physique sous lequel le corps pur est le plus stable à la pression
atmosphérique (1 bar) et pour une température donnée.
Enthalpie standard de
formation ΔfH°
On
appelle ainsi l'effet énergétique qui se manifeste lors de la
synthèse
totale (c-à-d. à partir des corps simples) d'une mole d'un composé
donnée, dans les conditions standards.
Par définition, l'enthalpie standard de formation d'un élément (C,
Fe...) ou d'un corps simple (O2, N2...)
est nulle.
Enthalpie de changement de
phase
elle correspond à la chaleur mise en jeux lors du changement d'état.
Enthalpie de réaction ΔH°r
chaleur mise en jeux lors d'une réaction chimique.
Energie de ionisation
Chaleur mise en jeux pour ioniser un atome.
Energie de
liaison
Variation
d'enthalpie lors de la formation d'une liaison à partir des atomes
isolés à l'état gazeux (réaction en général hypothétique). La valeur de
l'énergie d'une liaison entre deux atomes varie d'un composé à un
autre, les valeurs que l'on trouve dans les tables sont des valeurs
moyennes.
Pouvoir
calorifique
On
nomme ainsi la quantité de chaleur produite par la combustion de a)
pour les solide un kilo
de combustible b) 1m3 pour les gaz. On parle de
P.C. sup et inf suivant que l'on forme H2O
liquide ou gaz.