 Thermochimie -
chaleur de réaction
Thermochimie -
chaleur de réaction
Logiciels et bibliographie
Programme d'étude
Cours
Thermochimie
- Chaleur et température*
- Enthalpie*
- Chaleur de réaction*
- Calcul de l'enthalpie*
- Applications*
- Exercices*
- Tables de thermochimie*
Enthalpie de réaction ΔHr est la différence entre l’enthalpie du système final et celle du système initial.
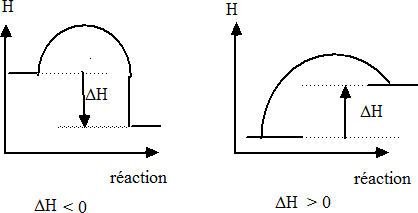 |
Quand la réaction dégage de l'énergie (exothermique), le système perd de l'énergie et ΔHr est négatif. Pour pouvoir comparer entre elles les enthalpies de différentes réactions, on définit un état standard : 25oC et 1 atm (Conditions normales et non CNTP). On appelle enthalpie standard de réaction ΔHro l'enthalpie mesurée dans ces conditions. |
Exemples :
2H2 + O2  2 H2O
ΔHr°
= - 483.6 kJ/mol donc exothermique
2 H2O
ΔHr°
= - 483.6 kJ/mol donc exothermique
P4
+ 3O2  P4O6
ΔHr° = -
1720 kJ/mol
donc exothermique
P4O6
ΔHr° = -
1720 kJ/mol
donc exothermique
glace  eau
ΔHfus =
6.03 kJ/mol
donc endothermique
eau
ΔHfus =
6.03 kJ/mol
donc endothermique
Lorsqu'une réaction est réversible, elle est exothermique dans un sens et endothermique dans l'autre; ΔH° a la même valeur absolue dans les deux sens, mais un signe opposé:
½
N2
+ ½O2  NO
ΔHr°
= + 90.4 kJ
NO
NO
ΔHr°
= + 90.4 kJ
NO  ½
N2
+ ½ O2 ΔHr°
= -
90.4 kJ
½
N2
+ ½ O2 ΔHr°
= -
90.4 kJ
Exercice
H2
(g) + ½
O2 (g)  H2O
(l) ΔHr°
= - 288.8 kJ
H2O
(l) ΔHr°
= - 288.8 kJ
H2 (g) +
½O2 (g)  H2O
(g) ΔHr°
= - 242.7 kJ
H2O
(g) ΔHr°
= - 242.7 kJ
A quoi correspond cette différence
de 46.1 kJ ? 
Mesure du ΔH d'une réaction
La connaissance du ΔH d'une réaction est intéressante car dans une certaine mesure elle permet de prévoir le sens d'une réaction spontanée.
Une méthode de mesure de ΔHr est la mesure directe de la chaleur mise en jeu au cours d'une réaction, à l'aide d'un calorimètre :
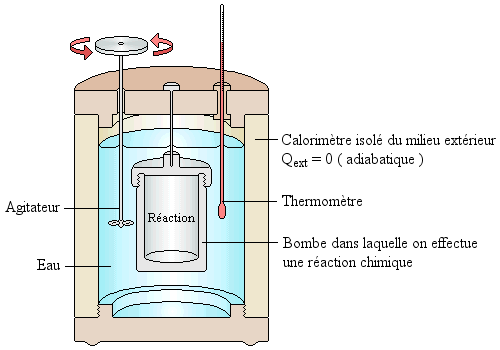 Réf: http://nte-serveur.univ-lyon1.fr/gerland1/cours/cours5/calorimetre.gif |
Le récipient isolé contient
une masse connue d'eau. Les valeurs de ΔH mesurées sont reportées dans des tables numériques. On procède comme suit pour ces déterminations :
|