 Thermochimie -
calcul de l'enthalpie
Thermochimie -
calcul de l'enthalpie
Logiciels et bibliographie
Programme d'étude
Cours
Thermochimie
- Chaleur et température*
- Enthalpie*
- Chaleur de réaction*
- Calcul de l'enthalpie*
- Applications*
- Exercices*
- Tables de thermochimie*
Méthode 1
L'enthalpie de formation d'une substance est indépendante de la méthode utilisée pour l'obtenir.
ΔH°r
= 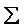 ΔHf°
(produits) -
ΔHf°
(produits) - 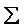 ΔHf°
(réactifs)
ΔHf°
(réactifs)
Exemple:
C(c) + O2
(g)  CO2 (g)
ΔHr°
= - 394 kJ/mol - 0 - 0
= -394 kJ/mol
CO2 (g)
ΔHr°
= - 394 kJ/mol - 0 - 0
= -394 kJ/mol
Méthode 2
L'enthalpie globale d'une réaction en plusieurs étapes est égale à la sommes des enthalpies des réactions intermédiaires (loi de Hess). Autre formulation: la variation d'enthalpie du système ne dépend que de son état initial et de son état final, mais pas des étapes intermédiaires (si la loi de Hess se trouvait infirmée, cela signifierait que le mouvement perpétuel est possible !).
ΔH°r
= 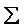 ΔH°ri
ΔH°ri
Exemple :
C(c) + 1/2 O2
(g)  CO (g) ΔHr1° =
- 110.5 kJ/mol
CO (g) ΔHr1° =
- 110.5 kJ/mol
CO (g) + 1/2 O2
(g)  CO2 (g)
ΔHr2°
= - 283 kJ/mol
CO2 (g)
ΔHr2°
= - 283 kJ/mol
C(c) + O2
(g)  CO2 (g)
ΔHr°
= - 394 kJ/mol
CO2 (g)
ΔHr°
= - 394 kJ/mol
Méthode 3
Une réaction peut se résumer en des liaisons brisées et d'autres formées. En connaissant l'énergie de chaque liaison, on peut par différence entre la situation initiale et la situation finale trouver l'énergie mise en jeux.
Les valeurs des énergies de liaisons que l'on trouve dans les tables sont des moyennes car la force d'une liaison dépend aussi des autres liaisons des atomes liés. Cette méthode donne donc un ordre de grandeur.
Exemple:
 CO2
(g) +
2H2O (g)
CO2
(g) +
2H2O (g)|
Énergie
absorbée par les ruptures de liaisons |
Énergie
dégagée par la formation des liaisons |
|
4
. C-H = 4 .
413.1 = 1652.4 kJ/mol 2
. O=O = 2 .
498.4 = 996.8 kJ/mol TOTAL: 2649.2 kJ/mol |
2
. C=O = 2 .
803.5 = 1607 kJ/mol 4
. O-H = 4 .
462.9 = 1851.6 kJ/mol TOTAL: 3458.6
kJ/mol |
ΔHr° = - 809.4 kJ/mol. Dans les tables, on trouve - 890.6 kJ/mol, mais avec formation d'eau liquide, il faut donc encore soustraire l'énergie dégagée pour le changement d'état donc 2 · 44 kJ/mol, ce qui donne -897.4 kJ/mol, l'ordre de grandeur est donc assez bon.
Exercices
Exercice
1: Calculer l'enthalpie standard de la réaction
d'hydrogénation de l'éthyne en éthène:
C2H2(g) + H2(g)
→ C2H4(g)
Cette
réaction n'est pas facile à faire en laboratoire à
cause des nombreux sous-produits. Utiliser les données:
2
C2H2(g) + 5 O2(g)
→ 4 CO2(g) + 2 H2O(l)
∆H° =
- 2600 kJ
2 C2H4(g) + 6 O2(g)
→ 4 CO2(g) + 4 H2O(l)
∆H° =
- 2822 kJ
2 H2(g) + O2(g) → 2 H2O(l)
∆H° = - 572 kJ

Exercice
2: Calculer l'enthalpie de la réaction de l'exercice 1,
cette
fois à l'aide des énergies de liaisons. 
Exercice
3: Calculer l'enthalpie de la réaction de l'exercice 1,
cette
fois à l'aide des enthalpies de formation trouvées dans
les tables. 