 Déroulement des
réactions chimiques - enthalpie libre
Déroulement des
réactions chimiques - enthalpie libre
Logiciels et bibliographie
Programme d'étude
Cours
Déroulement des réactions
- Collision des réactifs
- Catalyseur
- Probabilité et déterminisme
- Réaction spontanée
- Entropie
- Enthalpie libre
- Principes thermodynamiques
- Applications
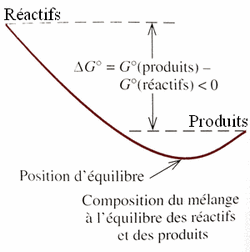
ΔG = ΔH - T · ΔS
G est l'enthalpie libre de Gibbs. Le principe est que G ne peut que diminuer dans une réaction spontanée.
Autrement dit; ΔG < 0 pour une réaction spontanée.
On peut constater que:
- Si la réaction est exothermique (ΔH <0), on abaisse ΔG.
- Si on augmente le désordre (ΔS > 0), on abaisse ΔG.
On peut trouver dans des tables les valeurs de ΔH et ΔS et ainsi prévoir la spontanéité d'une réaction.
Illustrations
- En solution concentrée, un solide dissout dans l'eau peut cristalliser, ceci de manière spontanée. Nous avons ici une augmentation de l'ordre puisqu'on obtient un cristal, comme ce processus est spontané et qu'il augmente l'ordre dans une partie du système, il est obligatoire que cette cristallisation s'accompagne d'une augmentation de chaleur (donc en fait d'une augmentation du désordre ambiant).
|
 |