Déroulement des
réactions chimiques - collision des réactifs
Déroulement des
réactions chimiques - collision des réactifs
Logiciels et bibliographie
Programme d'étude
Cours
Déroulement des réactions
- Collision des réactifs
- Catalyseur
- Probabilité et déterminisme
- Réaction spontanée
- Entropie
- Enthalpie libre
- Principes thermodynamiques
- Applications
Pour que deux réactifs réagissent, il faut qu'ils se rencontrent, donc qu'ils bougent (température) et qu'ils soient en nombre suffisant (concentration).
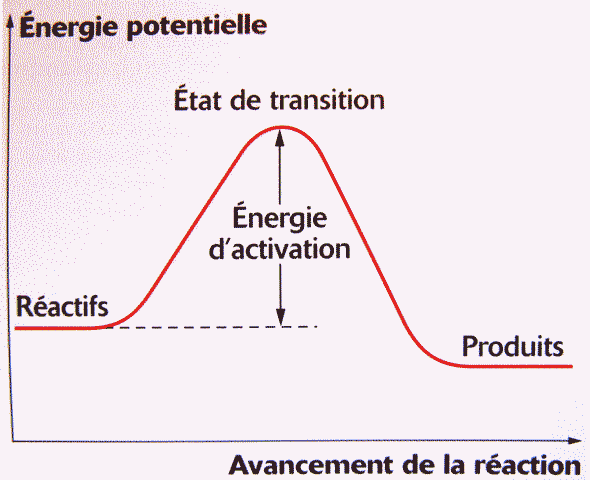
Il faut aussi que la collision se fasse à l'endroit ou les liaisons doivent changer (orientation et forme de la molécule) et ceci avec une vitesse suffisante. C'est très rarement le cas, souvent il n'y a qu'un choc efficace sur plusieurs milliards. Si toutes les collisions étaient efficaces, les réactions chimiques se dérouleraient toutes comme des explosions et la vie, siège de très nombreuses réactions, ne serait pas possible.
|
|
Pour qu'une réaction se passe, il faut souvent "investir" une certaine énergie au départ, pour en récupérer parfois plus encore à l'arrivée. Par exemple pour brûler du bois (donc faire une réaction de combustion) il faut commencer par allumer le feu (énergie d'activation), ensuite la totalité du bois brûlera sans aucun apport extérieur. |