 Déroulement des
réactions chimiques - applications
Déroulement des
réactions chimiques - applications
Logiciels et bibliographie
Programme d'étude
Cours
Déroulement des réactions
- Collision des réactifs
- Catalyseur
- Probabilité et déterminisme
- Réaction spontanée
- Entropie
- Enthalpie libre
- Principes thermodynamiques
- Applications
Quand on étire un élastique, on peut constater en l'approchant des lèvres qu'elle s'échauffe. Voyons ce que cela signifie:
Nous avons un échauffement donc ΔH <0
Ce n'est pas spontanné donc ΔG > 0
Comme ΔG = ΔH - T · ΔS on peut trouver le signe de ΔS:
ΔS = (ΔH - ΔG)/ T et comme T est positif, ΔH <0 et ΔG > 0, alors ΔS est négatif.
Nous avons donc une augmentation de l'ordre, ce qui est bien le cas si on s'intéresse à la structure moléculaire de ce polymère formé de longues chaînes enmêlées:
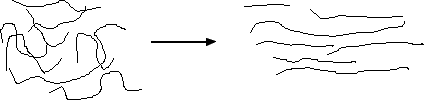
On passe d'une situation où les molécules sont très désordonnées à un arrangement plus régulier!
Recyclage de l'aluminium
Pour recycler l'aluminium, il faut le chauffer jusqu'à son point de fusion (660°C) puis le faire fondre:
Chaleur de fusion: 10.7 kJ/mol capacité calorifique: 0.900 J/g·°C
Q = m · c · ΔT ce qui donne pour une température de départ de 25°C Q = 15.4 kJ
Donc au total pour recycler 1 mole d'aluminium, il faut: 15.4 kJ + 10.7 kJ = 26.1 kJ
Pour extraire l'aluminium à partir de minerai, on fait la réaction:
Al2O3
+ 3 C(s)  2 Al(s) + 3 CO
(g) avec ΔH° = 1339 kJ/mol et ΔS° = 586 J/mol·K
2 Al(s) + 3 CO
(g) avec ΔH° = 1339 kJ/mol et ΔS° = 586 J/mol·K
A 1000°C (temp. de travail): ΔG = ΔH - TΔS° = 593 kJ ceci pour 2 moles
Donc au total pour produire 1 mole d'aluminium, il faut environ 297 kJ
Le recyclage ne demande donc que les 9 % de l'énergie nécessaire pour l'extraire de la roche.