Déroulement des
réactions chimiques - catalyseur
Déroulement des
réactions chimiques - catalyseur
Logiciels et bibliographie
Programme d'étude
Cours
Déroulement des réactions
- Collision des réactifs
- Catalyseur
- Probabilité et déterminisme
- Réaction spontanée
- Entropie
- Enthalpie libre
- Principes thermodynamiques
- Applications
Un catalyseur est une substance qui facilite une réaction sans y participer directement. Il en existe de nombreuses sortes, qui agissent à différentes étapes de la réactions.
Certains fixent les réactifs de manière à ce qu'ils soient proches l'un de l'autre, ceci grâce à un support finement divisé (catalyseur physique), d'autres rendent le site de réaction plus "attractif", soit en forçant la molécule à prendre une forme particulière, soit en déplacant le nuage électronique (catalyseur chimique).
On distingue aussi les catalyseurs que l'on peut récupèrer après la réaction de ceux qui ne sont plus utilisables.
On peut aussi faciliter la réaction en l'effectuant en plusieurs étapes, c'est souvent plus facile car les énergies d'activation sont plus faciles à atteindre. Les réactions dans les êtres vivants sont souvent effectuées en plusieurs dizaines d'étapes qui, additionnées, demandent en fait moins d'énergie et ont un bien meilleur rendement que celles réalisées en une seule étape dans une usine de produits chimiques. De plus dans les être vivants, beaucoup de réactions sont catalysées par des enzymes.
Illustrations:
Le pot catalytique
La combustion idéale de l'essence (qui est un hydrocarbure) donne du CO2 et de l'eau, malheureusement cette réaction très rapide à haute température donne aussi d'autres produits:CnH2n+2 + a O2 + b N2
 c CO2 + d CO (toxique)
+ e C (fumée noire) + f H2O
+ g NOx (toxique)
c CO2 + d CO (toxique)
+ e C (fumée noire) + f H2O
+ g NOx (toxique)Des billes de céramique recouvertes de platine, de palladium ou de rhodium, situées à l'intérieur d'un tube en acier, catalysent l'oxydation de CO et la réduction de NO, Les produits alors rejetés (CO2, H2O, N2 ) sont stables et non toxiques. Un tel dispositif est cher et incompatible avec de l'essence « au plomb », car le Pb empoisonne le catalyseur et le rend inefficace.
 |
L'oxyde de
cobalt (Co3O4)
s'utilise comme catalyseur dans les pots d'échappement pour
la combustion complète du monoxyde de carbone:
2 NO + 2 CO  N2 +
2 CO2 N2 +
2 CO2
Le sulfure de cobalt-molybdène (avec de l'oxyde d'aluminium comme support) catalyse la réaction: CO + H2O  CO2 +
H2
CO2 +
H2 |
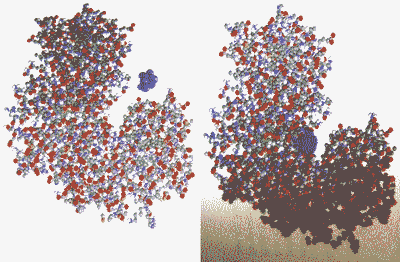
La catalyse enzymatique
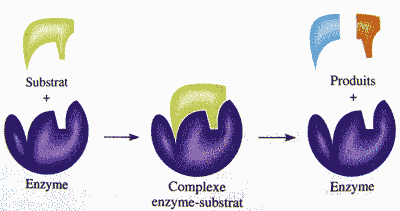 |
Vue simplifiée |
|
|
Vue plus "réelle" (une enzyme est une protéine) |