Vitesse de
réaction - vitesse des molécules
Vitesse de
réaction - vitesse des molécules
Logiciels et bibliographie
Programme d'étude
Cours
Vitesse de réaction
- Vitesse des molécules*
- Collisions*
- Effet de la concentration*
- Effet de la température*
- Catalyseurs*
- Lois cinétiques*
Pour qu'une réaction entre deux molécules se produise il faut naturellement qu'elles s'entrechoquent. Si ce choc n'est pas assez violent ou que l'angle n'est pas bon, les deux particules "rebondissent" sans réagir.
|
|
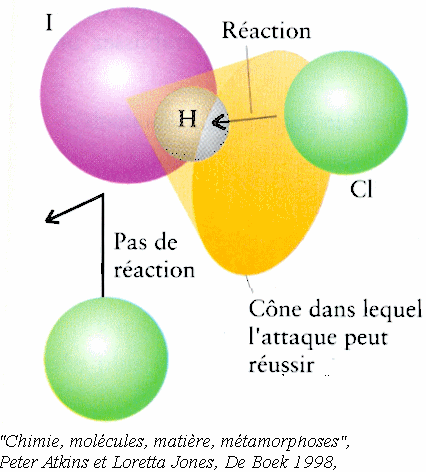
Réaction entre un atome de Cl et une molécule de HI. L'énergie du choc dépend de deux facteurs :
|
On appelle énergie d'activation
l'énergie minimum que doit avoir le choc pour qu'il y ait
réaction.
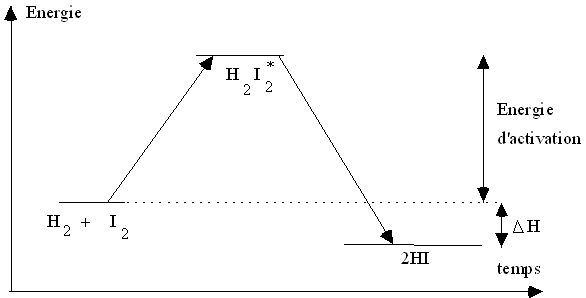
Exemple
La réaction à l'état gazeux entre l'iode I2
et le dihydrogène H2 : H2
+ I2  2 HI
2 HI
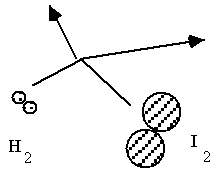 |
Choc élastique, pas de réaction |
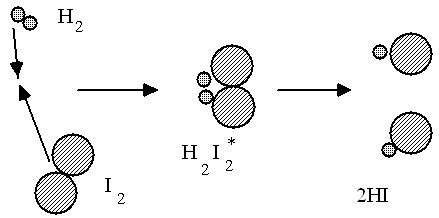 |
Le choc est efficace, les molécules ont assez d'énergie pour former un produit intermédiaire instable H2I2* qui se décompose en 2HI |
Représentation sur un diagramme d’énergie :
Exercice
1 : Pour qu'une réaction se
passe facilement, faut-il que l'énergie d'activation soit petite ou
grande? 
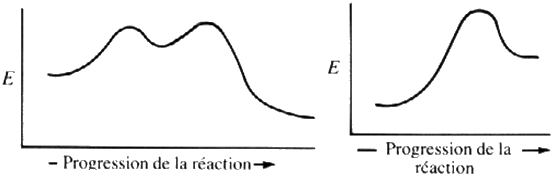
Exercice 2 : Sur chacun des graphiques
suivants, indiquer :
a)
où se trouvent les réactifs et les
produits.
b) l'énergie
d'activation. c) ΔH
de la réaction.