 Stœchiométrie
- Calculs avec des gaz
Stœchiométrie
- Calculs avec des gaz
Logiciels et bibliographie
Programme d'étude
Cours
Stœchiométrie
- Masse atomique et molaire
- Equation et réaction chimique
- Calculs avec les équations chimiques
- Calculs avec des solutions aqueuses
- Facteurs expérimentaux
- Analyse élémentaire*
- Calculs avec des gaz*
- Exercices*
Pour faire des calculs stoechiométriques, il faut transformer les volumes en nombre de moles.
Loi des gaz parfaits
Le modèle des gaz parfaits, un modèle simple qui a une très bonne précision dans les conditions usuelles de travail en chimie.
Les hypothèses de départ sont:
- Diamètre des particules négligeable par rapport à la distance entre elles.
- Pas d'autres interactions que des chocs aléatoires.
- Ces chocs sont parfaitement élastiques (Ecin conservée).
Les particules d'un gaz se déplacent à grande vitesse, quand elles heurtent un obstacle, cela crée de la pression sur celui-ci.
Comme la pression est:
- Proportionelle à la quantité de gaz n
- Proportionnelle à la température, en partant du "vrai" zéro donc en unité kelvin
- Inversement proportionnel au volume à disposition.
On a la formule P · V = n · R · T
La constante de
proportionalité R dépend des unités choisies, nous avons:
| Pression | Volume | Quantité | Constante | Température |
| P [atm] | V [L] | n [mole] | 0,08206 | T [°K] |
| P [Pa] | V [m3] | n [mole] | 8,31441 | T [°K] |
| P [mmHg] | V [L] | n [mole] | 62,37 | T [°K] |
1 atm = 760 mm de Hg. = 101'300 Pa. (1 Bar = 100'000 Pa 1kPa = 1 mbar)
On parle de
"conditions normales" CNTP
(Condition Normales de Température et de Pression) quand la
pression est
de 1 atmosphère et la température de 0°C.
Dans ces conditions, le volume d'une mole de gaz est de 22,4
litres (volume molaire).
Loi de Dalton
Dans un mélange gazeux, la pression totale du mélange est la somme des pressions partielles de chaque constituant (Dalton 1801).
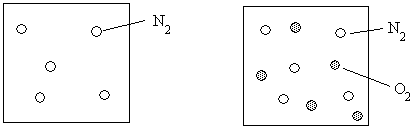
Ptot = PN2 Ptot = PN2 + PO2
Exercices
Quand cela n'est pas spécifié, on admettra que nous nous trouvons dans des conditions normales de température et de pression (NTP).
Exercice
1: Démontrer
que le volume molaire normal d'un gaz est bien de
22.4 litres. 
Exercice 2: On
a 100 l d'O2 aux conditions normales. Que devient ce volume à
100°C et 5 atm.? (masse ne varie pas) 
Exercice 3: A
quelle température faut-il porter 190 l de CO à 0,95
atm. et 0°C pour obtenir un volume de 250 l à 1 atm.?
(masse ne varie pas) 
Exercice 4: Quelle
est la masse volumique du gaz SO2
aux conditions normales? 
Exercice 5: Quelle
est la masse de 448 litres de CO2?

Exercice 6: Un
corps pur gazeux a une masse volumique de 2,86 g/l. Quelle
est sa masse moléculaire? 
Exercice 7: Quels
volumes de dihydrogène et de dioxygène
obtiendra-t-on en décomposant
900 g d'eau? 
Exercice 8: Un
gaz occupe 58.5 mL sous une pression
de 52 kPa et 30°C. Que deviendra cette pression si on augmente le
volume à 2.3 L sans changer la température? 
Exercice 9: Dans
un ballon rigide à 30°C,
la pression d'un gaz est de 0.90 atm. Quelle température
indiquera le thermomètre si la pression baisse de 0.10
atm? 
Exercice
10: On
a 3 récipients de 4.0 L
chacun, contenant respectivement de l'hélium, du dioxygène
et du dioxyde de carbone aux conditions normales de température
et de pression.
a) Quel récipient contient le plus de
molécules de gaz?
b) Quelle est la masse de gaz contenue
dans chacun des récipients? 
Exercice
11: Quelle
est la masse maximum de pentane
(C5H12) qui peut être
brûlée
si on ne dispose que de 17.0 g de dioxygène (O2)?

Exercice
12: Une
réaction très rapide
utilisée pour les "air-bag" des voitures est la
décomposition du NaN3 (s) en sodium métallique
et en diazote (g).
a) Ecrire la réaction.
b)
Quel volume de diazote, mesuré à 25°C et 1 atm sera
généré par la décomposition de 73.0 g de
NaN3? 
Exercice
13: Quels
volumes de dihydrogène(g) et de diazote(g) faut-il pour
obtenir par synthèse 1000 litres de gaz ammoniac?
3
H2
+ N2  2 NH3
2 NH3 
Exercice
14: Un
gaz
combustible est composé de 50% de dihydrogène, 30% de
méthane et 20% de diazote (en volume). Par combustion, le
dihydrogène donne de l'eau; le CH4
du CO2
et de
l'eau. Le diazote n'entre pas en réaction. On demande: les
équations de combustion, le volume de dioxygène
nécessaire à la combustion d'un mètre cube de ce
gaz ainsi que la masse d'eau, le volume de CO2
obtenu et la masse volumique du mélange gazeux. 
Exercice
15: Lors
de la
transformation du sucre en alcool
C6H12O6  2C2H6O
+ 2CO2
2C2H6O
+ 2CO2
il se
dégage 112 litres de CO2
(gaz
carbonique). Calculer le poids de sucre décomposé. 
Exercice
16: On
mélange 2.8 litres de méthane (CH4), à
25°C et à 167 kPa, à 35 litres d'oxygène
(O2), à 31°C et à 127 kPa. On
enflamme le mélange pour produire du dioxyde de carbone et
de l'eau. Calculer le volume de CO2 produit à
253
kPa et à 125 °C. . 
Exercice
17: Aux
conditions normales, il faut 140 l de O2 pour
brûler
100 l d'un mélange de CH4 et de CO. Calculer sa
composition centésimale. 
Exercice
18: Déterminer
la formule d'un hydrocarbure gazeux contenant 85.69 % de C, 14.31 %
de H. Si à 27°C et 700 mm Hg si 300 ml de ce gaz pèsent
0.6277 g. 
Exercice
19: On
recueille N2 à 22 °C au-dessus de l'eau
(pression de H2O = 20 mm.de Hg à 22
°C),
alors que la pression atmosphérique vaut 727 mm de Hg. Quelle
est la pression d'azote sec dans les mêmes conditions ? 
Exercice 20: On
a 4 l de
H2 à 250 °C sous 25,00 atm ; quel sera le
volume de H2 à 25 °C sous 1 atm ? 
Exercice 21: Une
masse
de 1.5 g de gaz inconnu occupe un volume de 8.4 litres aux CNTP.
Quel
sera son volume à 91 °C, sous pression normale
?
Quel est ce gaz ? Quel sera son volume sous une pression de 84 cm
Hg, à 0 °C ? 
Exercice 22: Soit
un
mélange de 4.2 g de N2 et 3.2009 g de O2
(gazeux) que l'on place dans un récipient contenant un liquide
X à 0 °C. La pression intérieure totale vaut
581 mm Hg et le volume final = 7.6 l. Quelle est la pression de
vapeur de X ? 
Exercice 23: La
combustion de C donne du CO2. On fait
réagir
45 g de C et 1500 cm3 de O2,
à 25 °C
et sous 5 atm. Combien obtient-on de grammes de CO2
? 