 Stœchiométrie
- Analyse élémentaire
Stœchiométrie
- Analyse élémentaire
Logiciels et bibliographie
Programme d'étude
Cours
Stœchiométrie
- Masse atomique et molaire
- Equation et réaction chimique
- Calculs avec les équations chimiques
- Calculs avec des solutions aqueuses
- Facteurs expérimentaux
- Analyse élémentaire*
- Calculs avec des gaz*
- Exercices*
A partir de la formule d'un composé on peut connaître la quantité de chaque élément qui est présent dans le composé et inversement.
Application 1
On extrait une tonne de minerai de fer hématite (Fe2O3). En connaissant le % de fer dans Fe2O3, on trouvera facilement la quantité de fer que l'on peut obtenir:
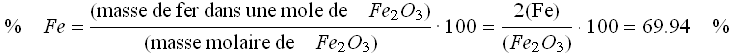
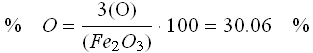
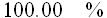
Il y a donc 699 kg de fer dans une tonne de ce minerai.
Application 2
Il est relativement facile de déterminer la composition d'une substance. On peut alors trouver la formule brute de la substance.
La composition d'un composé organique est la suivante: 58,8% de C, 9,8 % de H et 31,4 % de O. La masse molaire est de 204 g. Quelle est sa formule?
Marche à suivre pour trouver la formule brute :
- Utiliser les % pour calculer les masses de chaque élément par 100 g de composé.
- Convertir les masses de chaque élément en nombre de moles de ces mêmes éléments.
- Diviser chaque nombre de moles par le plus petit d'entre eux.
- Multiplier ces fractions par un même nombre pour obtenir des nombres entiers.
n(C) = 58.8/12.01 = 4.896 n(H) = 9.8 / 1.01 = 9.703 n(O) = 31.4 / 16.00 = 1.963
n(C) / n(O) = 2.495 n(H) / n(O) = 4.944 On trouve donc aux imprécisions expérimentales près:
5 C pour 2 O et 5 H pour 1 O La formule brute est donc C5H10O2.
Pour trouver la formule chimique on tient compte de la masse molaire:
M(C5H10O2) = 102 g et comme la masse molaire est de 204, la formule chimique est C10H20O4
Exercices
Exercice
1:Une substance a la
composition suivante: 11,19% de H et 88,81 % de O. Quelle est sa
formule ? 
Exercice
2:Quelle est la formule
brute du chlorure de magnésium si 2,55 g de Mg se combine avec
7,45 g de Cl pour former 10 g de ce composé. 
Exercice
3: Une pièce
de monnaie en argent ayant une masse de 5,82 g est dissoute dans de
l'acide nitrique. Lorsqu'on ajoute du NaCl à la solution,
l'argent précipite sous forme de AgCl. Le précipité
de AgCl a une masse de 7,2 g. Déterminer la teneur en argent
de la pièce de monnaie. 
Exercice
4:La vitamine C
contient seulement C, H et O. Un échantillon de 6,49 mg donne
après combustion 9,74 mg de CO2 et 2,64
mg de
H2O. Quelle est la formule brute de la
vitamine C? 