Réactions
chimiques: Réactions ioniques
Réactions
chimiques: Réactions ioniques
Logiciels et bibliographie
Programme d'étude
Cours
Reactions chimiques
- Lois pondérales
- Equation chimique
- Types de réactions
- Réactions ioniques*
- Exercices*
Réaction acide-base (neutralisation)
Lorsque des cations H+ et des anions OH- se trouvent dans une même solution, ils se lient pour former de l'eau (que l'on peut considérer comme un non électrolyte):
H+ + OH-  H2O
H2O
Cette réaction apparaît chaque fois qu'on fait réagir un acide avec un hydroxyde:
NaOH
+ HCl  H2O + NaCl
H2O + NaCl
Na+
+ OH- + H+
+ Cl-  H2O
+ Na+ + Cl-
H2O
+ Na+ + Cl-
La première équation est l'équation moléculaire, la deuxième est l'équation ionique.
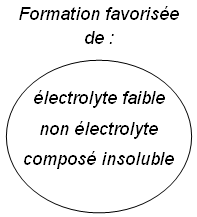
Formation d'un électrolyte faible ou d'un non électrolyte
Si on trouve, dans une solution, des ions susceptibles de former un électrolyte faible, celui-ci se forme :
KF et HCl sont deux
lectrolytes forts: K+
+ F- + H+ + Cl-  HF
HF  + K+ +
Cl-
+ K+ +
Cl-
HF est par contre un
électrolyte faible, comme l'indique le tableau:

Les non électrolytes qui peuvent se former sont généralement des anhydrides d'acides instables, ou 1'ammoniac NH3 :
Na2CO3 + 2 HCl
2Na+ + CO32- + 2H+ + 2Cl-  [H2CO3] + 2Na+ + 2Cl-
[H2CO3] + 2Na+ + 2Cl-  H2O + CO2
H2O + CO2 +
2Na+ + 2Cl-
+
2Na+ + 2Cl-
NH4Cl + NaOH
NH4+
+ Cl- + Na+
+ OH-  NH3
+ H2O + Na+ + Cl-
NH3
+ H2O + Na+ + Cl-
Formation d'un composé insoluble
Si on trouve, dans une solution, des ions susceptibles de former un composé insoluble, celui-ci se forme (et un précipité apparaît) :
BaCl2 + Na2SO4
Ba2+ +
2Cl- +
2Na+
+ SO42-  BaSO4
BaSO4  + 2Na+
+ 2Cl-
+ 2Na+
+ 2Cl-
Pour savoir si un
composé est soluble,
on peut utiliser un tableau (  )ou se
baser sur les principes suivants,
qu'il faut appliquer dans l'ordre donné:
)ou se
baser sur les principes suivants,
qu'il faut appliquer dans l'ordre donné:
Règles de solubilité :
- Les sels de sodium(Nax+),
de potassium(Kx+) et d'ammonium (NH4x+)
sont
solubles.
- Les nitrates (NO3-),
les acétates(CH3COO -)
et les perchlorates (ClO4-)
sont solubles.
- Les sels d'argent(Ag+),
de
plomb(Pbx+) et de mercure(Hgx+)
sont insolubles.
- Les chlorures(Clx-),
les
bromures(Brx-) et les iodures(Ix-)
sont solubles.
- Les carbonates (CO3
-
-), les sulfures(Sx-), les oxydes(Ox-)
et les
hydroxydes(OHx-) sont insolubles.
- Les sulfates (SO4--)
sont solubles sauf les sulfates de calcium ou de baryum.
Par exemple AgNO3 est soluble car la règle 2 est prioritaire sur la règle 3
N.B. Si on met un composé insoluble dans une solution, le composé reste généralement à l'état solide et il n'y a pas de réaction ionique. Toutefois, si la solution contient un acide fort et que le composé insoluble est un hydroxyde ou un sel d'acide faible, il y aura très souvent une réaction.
Exercices
Exercice 1: Que se passe-t-il lorsqu'on mélange des solutions des électrolytes suivants:

a) (NH4)2CO3 et HCl b) (NH4)2CO3 et NaOH
c) Ba(OH)2 et H2SO4 d) CuSO4 et Fe(NO3)3
Exercice 2:
a) Que se passe-t-il quand on mélange une solution de
Na2CO3 avec une solution
de CaCl2?
(écrire aussi l'équation équilibrée).
b)
Si on acidifie la solution obtenue en a), que se passe-t-il? (écrire
aussi l'équation équilibrée)