 Réactions
chimiques: Lois pondérales
Réactions
chimiques: Lois pondérales
Logiciels et bibliographie
Programme d'étude
Cours
Reactions chimiques
- Lois pondérales
- Equation chimique
- Types de réactions
- Réactions ioniques*
- Exercices*
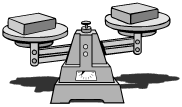 Lois
relatives aux masses
Lois
relatives aux masses
Loi de Lavoisier:
La masse totale des produits formés est égale à la masse totale des réactifs consommés.
Loi de Proust (ou loi des proportions définies):
Un composé donné contient toujours les mêmes éléments combinés dans les mêmes proportions en masse.
Loi de Dalton (ou loi des proportions multiples) (pour des corps qui peuvent se combiner dans différentes proportions comme par exemple N2O, NO, N2O3, NO2, N2O5).
Les masses, de l'un des éléments s'unissant à une même masse de l'autre, sont toujours dans le rapport de nombres entiers (simples).
Exercice 1: Trois
échantillons de carbone
pesant 3.10 g, 5.50 g et 8,25 g ont été brûlés
dans du dioxygène (O2)
de façon à former exclusivement du dioxyde de carbone
(CO2).
La masse
de dioxyde obtenue a été respectivement: 11.36 g, 20.16
g. et 30,25 g. Ces données permettent-elles de montrer que le
dioxyde de carbone a une composition constante? 
Exercice 2: Comment
peut-on justifier le fait que
la croissance d'un arbre ou la combustion d'une bougie respecte la
loi de conservation de la matière? 