 Les éléments:
Masse
Les éléments:
Masse
Logiciels et bibliographie
Programme d'étude
Cours
Les éléments
- Masse
- Ondes
- Structure électronique
- Structure électronique moderne*
- Tableau périodique
- Electronégativité
- Taille des éléments
- Famille et éléments
On a définit un élément comme étant l'ensemble des atomes ayant a l'état neutre les mêmes propriétés chimiques, donc le même nombre de protons.
L'unité choisie pour la masse a été définie comme le douzième de la masse d'un atome de carbone-12. Un atome de carbone-12 a donc une masse de 12.0000 u (u signifie "unité de masse atomique")
Comme le nombre de neutrons peut varier, la masse d'un élément est définie comme la masse moyenne pondérée de ses différents isotopes. La matière ayant partout sur terre la même origine, la masse d'un élément ne varie pas.
Illustrations:
- L'élément carbone a une masse de 12.011 car cet élément est essentiellement constitué de carbone-12.
- Le iode a une masse atomique de 126,9 u car il est 126,9 fois plus lourd que le douzième d'un atome de carbone-12.
On représente par convention la
masse atomique moyenne
d'un élément par le symbole de
l'élément entre parenthèses. Par exemple: (C) = 12.011 u

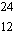 Mg
79
%
masse atomique 23,98 u
Mg
79
%
masse atomique 23,98 u
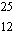 Mg
10
%
masse atomique 24,98
u
Mg
10
%
masse atomique 24,98
u
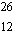 Mg
11
%
masse atomique 25,98
u
Mg
11
%
masse atomique 25,98
u
Quelle
est la masse atomique de l'élément magnésium? 