 Les éléments:
Structure électronique
Les éléments:
Structure électronique
Logiciels et bibliographie
Programme d'étude
Cours
Les éléments
- Masse
- Ondes
- Structure électronique
- Structure électronique moderne*
- Tableau périodique
- Electronégativité
- Taille des éléments
- Famille et éléments
Selon la théorie classique de l'électromagnétisme, si une charge électrique est soumise à une accélération, il y a émission d'un rayonnement électromagnétique.
Le mouvement d'un électron autour du noyau, auquel est associée une accélération centripète, devrait donc s'accompagner de l'émission permanente d'un rayonnement. L'énergie de cet électron diminuant ainsi progressivement, il devrait peu à peu de rapprocher du noyau et finalement tomber sur lui.
Or ceci n'est pas le cas: les atomes sont stables et leur durée de vie illimitée. Ils n'émettent de rayonnement que s'ils sont préalablement excités et ce rayonnement a un spectre discontinu. Un nouveau modèle tenant compte de ces contradictions a été imaginé en 1913 par Niels Bohr (physicien danois 1885-1962). Ce modèle est basé sur la théorie des quantas, théorie selon laquelle l'énergie échangée entre le rayonnement électromagnétique et la matière ne peut pas prendre n'importe quelle valeur, mais seulement des valeurs qui sont des multiples entiers des photons.
Modèle de Bohr
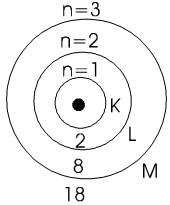 |
les électrons tournent en orbite autour du noyau comme les planètes tournent autour du soleil. (modèle planétaire)
|
Exercice 1:Représenter
selon le modèle de Bohr les atomes suivants: O, Na+,
Al, S2- 
Exercice 2:
Les éléments les plus importants pour la vie sont CHON. Pour ces
atomes, quel doit être le nombre d'électrons de la dernière couche pour
une bonne stabilité? 
Notation de Lewis
Lewis (1875-1946) a imaginé une notation simplifiée pour la structure électronique qui compte les électrons externes. Elle est très utilisée car les réactions chimique dépendent essentiellement de cette dernière couche.
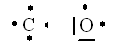 |
Dans cette notation les paires d'électron sont symbolisées par un trait et les électrons célibataires par un point. Jusqu'à 4 électrons, on indique des points puis ensuite on met des traits (ou des doubles points dans certains livres) pour représenter les paires d'électrons: |
Exercice 3:
Représenter la couche externe selon la
notation de Lewis des éléments suivants:
O, Na+, F, Cl-, Al, Ca,
Rb, Se, I, Kr, S2- 
Emission d'énergie par l'atome
Quand
un atome soumis à un apport d'énergie (=excitation), un électron peut
quitter sa place la plus stable (énergie minimum). Lorsque il retrouve
sa stabilité, il le fait en émettant la différence d'énergie sous forme
d'un rayonnment d'énergie bien définie. 
Application:
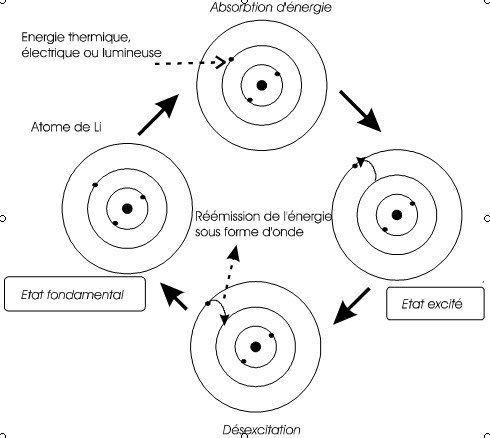 |
Quand on met un sel de Lithium dans la flamme, il émet une lumière rose. (C'est le même principe pour les feux d'artifice) Explication: A chaque fois, le photon émis a une énergie exactement égale à la différence d'énergie qu'il y a entre les orbites concernées. Les transitions entre états excités et état fondamental sont multiples. Chaque atome a ainsi sa "signature", ce qui permet d'analyser la composition d'une étoile par exemple. N.B. Un atome recevant une énergie suffisante sera ionisé positivement. |
Chaque atome a ainsi sa "signature:

 |
On observe cependant plus de
raies que ce qui est prévu avec le modèle en couche de Bohr. Ce modèle rend encore service de nos jours, mais il est insuffisant pour bien comprendre les propriétés des éléments. |