 Les éléments:
Taille des éléments
Les éléments:
Taille des éléments
Logiciels et bibliographie
Programme d'étude
Cours
Les éléments
- Masse
- Ondes
- Structure électronique
- Structure électronique moderne*
- Tableau périodique
- Electronégativité
- Taille des éléments
- Famille et éléments
La taille des atomes est importante pour la réactivité chimique, elle varie de manière prévisible dans le tableau périodique.
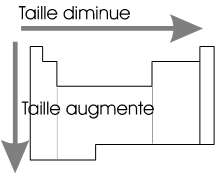 |
Lorsqu'on descend dans une colonne du tableau périodique, on ajoute des électrons dans des couches de plus en plus éloignées du noyau et le rayon des atomes augmente. Lorsqu'on se déplace de gauche à droite dans une période, on ajoute des électrons dans la même couche principale. Le nombre de protons augmentant également, les électrons sont de plus en plus attirés par le noyau, et le rayon des atomes diminue. |
Ces considérations ne sont valables que pour les atomes
neutres. 
La taille peut varier de façon très notable en cas de ionisation. Par exemple Na en perdant un électron perd aussi une couche électronique et devient beaucoup plus petit.
Illustration |
Le sel de cuisine est formé de cation Na+ et d'anions Cl-. Lors de sa formation à partir d'atomes neutres, il y a presque "inversion" des tailles entre ces deux éléments:
Cristaux de sel de cuisine (NaCl)
|
Exercice 1:
Classer les éléments suivants par rayon atomique croissant: Mg, Si, Cl,
K 
Exercice 2: Souligner pour chaque paire
ci-dessous l'élément qui a le rayon atomique le plus grand:
F,
Cl B,
Si
P, Al
Si, O
