 Les éléments:
Structure électronique moderne
Les éléments:
Structure électronique moderne
Logiciels et bibliographie
Programme d'étude
Cours
Les éléments
- Masse
- Ondes
- Structure électronique
- Structure électronique moderne*
- Tableau périodique
- Electronégativité
- Taille des éléments
- Famille et éléments
La notion d'orbite définie par Bohr a été remplacée par celle plus complexe d'orbitale qui décrit la portion de l'espace où il est le plus probable de trouver l'électron.
Couche
On répartit les électrons dans des couches énergétiques appelées K, L, M, N, O, P, Q ou respectivement 1, 2, 3, 4, 5, 6, 7.
L'énergie croit de la couche 1 à la
couche
7. Les électrons sont donc classés en fonction de leur
énergie et non de leur distance au noyau.
Le nombre d'électrons par couche correspond à celui du modèle de Bohr
(2, 8, 18, 32)
Sous-couche
les valeurs particulières d'énergie d'une
couche sont appelées sous-couches s, p, d, f. L'énergie
croit de s à f
Chaque sous-couche ne peut contenir plus
d'un certain nombre d'électrons:
2 dans la
sous-couche s
6 dans la
sous-couche p
10 dans la sous-couche d
14 dans la sous-couche f
Orbitale
La région de l'espace où il est le plus probable de rencontrer un électron ou une paire d'électrons est appelée orbitale.
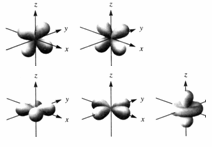
On a donc une orbitale s, 3 orbitales p, 5 orbitales d et 7 orbitales f :
 1 orbitale s (max 2 e-)
1 orbitale s (max 2 e-)

 |
 |
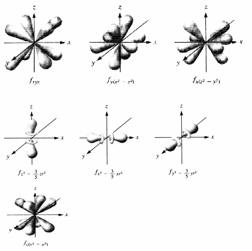 |
| 3 orbitales p (max 6 e-) | 5 orbitales d (max 10 e-) | 7 orbitales f (max 14 e-) |
Règles de remplissage:
- Les électrons occupent d'abord les niveaux d'énergie les plus faibles.
- Une orbitale d'une sous-couche ne reçoit pas un deuxième électron avant que toutes les orbitales de cette sous-couche n’en aient un.
 |
Exemple: Le cobalt a 27 électrons, il a
la
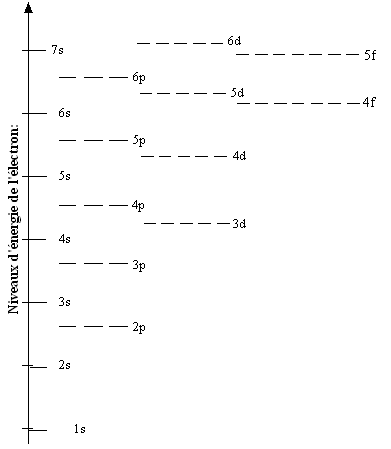
structure: que l'on écrit souvent: car 1s2 2s2p6 correspond a un élément ayant les deux premières couches complètes, le Néon. Cela raccourci l'écriture, surtout pour les éléments ayant beaucoup d'électrons. N.B. On peut remarquer que par exemple la sous couche 3d est à un niveau d'énergie supérieur à la 4s. Il y a donc un "mélange" des couches. Ceci sera important quand on parlera du tableau périodique. |
Exercice 1:
Donner la structure électronique du Fer. 
Exercice
2: Identifier les éléments suivants: a) [Kr]
4d10 5s2 b) [Xe] 4f145d6
6s2 c) [Kr] 4d10
5s2p6 