Les éléments:
Electronégativité
Les éléments:
Electronégativité
Logiciels et bibliographie
Programme d'étude
Cours
Les éléments
- Masse
- Ondes
- Structure électronique
- Structure électronique moderne*
- Tableau périodique
- Electronégativité
- Taille des éléments
- Famille et éléments
Comme les atomes sont plus stables avec une dernière couche complète, ils ont une tendance a perdre ou gagner des électrons qui varie avec la configuration de la dernière couche électronique.
Un élément de la colonne I a un électron sur sa dernière couche, il aura donc peu tendance a en prendre car il lui suffit d'en perdre un pour acquérir une dernière couche complète.
Au contraire, un élément de la colonne VII aura une forte tendance a gagner un électron pour avoir sa dernière couche complète.
Cette tendance à prendre des électrons est très importante pour comprendre la réactivité chimique. On appelle cette grandeur l'électronégativité. C'est un nombre sans unités qui décrit la tendance d'un atome à attirer un ou des électrons. Plus l'électronégativité d'un atome est grande, plus il attire les électrons.
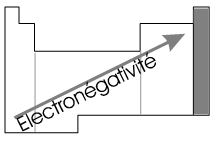
On trouve les valeurs d'électronégativité sur le tableau périodique. On considère en général que la colonne VII n'a pas d'électronégativité car ce sont des éléements avec une dernière couche complète.
|
|
L'électronégativité augmente
logiquement de:
|
Exercice 1:
Sans consulter des tables numériques, souligner
pour chaque paire l'élément le plus électronégatif.
Rb,
Cs Na,
Mg
N, F
S,
Se Cu, Zn
Ensuite, relever l'électronégativité donnée dans les tables
et vérifier les déductions faites. 
Exercice 2:
Sans
consulter les valeurs du tableau périodique, classer les éléments
suivants par électronégativité croissante:
H, He, Li, B, N, F, Na, S, Ar, Sr, Sn, Ra
Ensuite, relever l'électronégativité
donnée dans les tables et vérifier les déductions faites.